
Etiketter
- -2 homotrimeeri
- -4
- -5 homopentameeri
- (1
- (1q23.3)
- 17q11.2 sclerostin
- 25(OH)2D)
- 25(OH)2D3 kohdegeenejä
- 5-HT
- Acetabulum
- ACP amorfinen kalsiumfosfaatti
- ADAMTS4
- ADAMTS5 (21q21.3) Aggrekanaasi-2.
- adiponektiini
- Aggrekanaasi-1
- aiheesta
- aktiini
- alendronaatti
- ameloblasti
- anisotropia
- antaa .pyrofosfataasia
- Antiresorptiivinen aine
- Antiresorptiivinen aine. luutulehdus
- AR
- arakidonihappo
- Arg-Gly-Asp
- beeta-kateniinin
- Bifosfonaatit
- bifosfonaatti
- Bifosfonaatti ( Alendronaatti
- Biomineralisoituminen
- BM 40
- BMD ja luuytimennrasva
- BMP
- BMP-2
- BMP-antagonsiti
- BONJ
- båtben (hand)
- Calretikuliini(CRT)
- CDD
- CERAMENT hyvänlaatuisten luutuumorien hoidossa luuaineskorvike
- CERAMENT luun korvikeaine
- COL1
- Cx43
- DAND
- dentiini
- dentiinin ja luun orgaaninen faasi
- Dentistikandin kirjasta
- Deubikitinaasit(DUB) ja luun uudelleenmuovautuminen (Bone remodeling)
- ECM
- Edentata
- Efriinisignalointi ja luubiologia
- ei suomennettu
- ei-kollageeninen proteiini Non-Collagen proteins (NCP)
- endosteum (sisempi luukalvo)
- epäorgaaninen
- Epästabiili pertrokanteerinen murtuma
- ERalfa
- estrogeeni
- ETA-1
- etäpesäke
- extrasellulaarinen
- farnesylpyrofosfaattisyntaasi
- femoraali epifyysi
- FGF23
- Fibronektiini
- Foolihappo
- Foolihapporeseptori FOLR1 ja hammasterveys (Tutkimus 2019) Gingiviitti ja periodontiitti
- Gas6
- GBM grafeeniperusteiset materiat
- Geeni SPP1
- Geeni THBS1
- Gene FN1
- geranylgeranioli
- GGOH
- GH
- Gingivitis
- GlaOC ( cOC)
- glukokortikoidi
- GluOC (ucOC)
- H+-ATPase
- HA tietokoneella
- hamamsinfektiot ja röntgenlöydöt ( tutkimus 2014)
- Hampaanpoiston jälkeinen paraneminen
- hampaattomuus
- HAP kide
- Hohkaluu( trabecular) osteoni (luuyksikkö)
- Honkonen&Nyman 2020 Nivussidevammoista kirjallisuuskatsaus
- huonosti parantuva luunmurtuma
- hyalektanaasi
- Hyaluronaanisynteesi ja hajoaminen
- hybrdidi karbonaattiapatiitti CO3Ap
- hydroksiapatiitti
- hydroxyapatiitti
- Hyperhomocysteinemia ja luustovaikutukset
- ibandronaatti
- IGF-1
- insuliini
- integriini
- interleukiini
- Irisiinin merkitys ihmisellä on tutkimuksen alainen asia
- iskukuormitus (impact)
- K-vitamiini (K2
- K-vitamiinista ajatuksia
- K2
- kalsium
- kalsiumhydroksiapatiitti
- kalsiumjoni
- Kanan maksa ja haima
- karbonoitunut hydroksiapatiitti
- Kariesoppi
- kaspaasi
- Katepsiini
- kemokiini
- Kiille
- Kliininen koe III vaihe
- koentsyymi Q
- Kollageeni I
- kollagenaasi
- kolmoishelix
- Kr. 4q22.1
- Kr. 5q31.3-q32
- Kr.2q34
- Kr.8q24
- kuoriluu
- Kuoriluu( cortical)
- Käden luu ja niveltymät
- KÄSI
- Lasikuitulujitettu komposiitti-implantti
- leikkaava voima( shear)
- LEP
- Ligand of Numb protein X4
- Limapussi eli bursa
- lining Cell
- Lining cells
- Linkkejä
- LINX2 ( 13q12.2)
- LNX geeniperheen molekulaarisesta evoluutiosta: Selkärankaisten hankittuja ominaisuuksia.
- LNX1 (4q12)
- LNX3 (3p13)
- LNX4 (12q12)
- LNX5 (Xq28)
- Lonkkamurtumat ovat ikääntyneillä tavallisin murtumalaji
- Lonkkanivel
- LRP-5
- LU1
- Luokan III Semaforiinit säätelevät luun homeostaasia. Sema3 -geenit 1
- luu
- Luu ja dieetti
- Luu ja lihas avaruudessa
- Luumassan homeostaasista . LNX1/2 E3ubikitiiniligaasit Numb binding proteins X1
- luun regeneroituminen
- Luun aineenvaihdunnan biokemiallisest mittarit
- Luun biokemiallinen kokoomus (Somogyi-Ganss)
- Luun biologiasta
- Luun biomateriaalit (Cardemil)
- luun homeostaasi
- Luun uudismuodostuksen prosessista
- Luunmurtuman paraneminen
- luusolu
- Luusto ja K-vitamiini
- luusto ja nivelrusto
- Luustomassan homeostaasin säätelyproteomista
- Luustometastaaseista
- luustometastaasi
- luuston homeostaasi
- Luuston osuus systeemisessä endokriinisssä säätelyssä
- Luutumattoman murtuman paranemisen edistäminen
- Luuydin ja glykotoksisuus. AGEs
- Luuydinadiposyytti ja remodeling
- Luuydinlipidien kirjo
- Luuydinrasva
- Lääkekehittely
- M-CSF
- magnesium
- Magnesium ja IP6 implantissa
- magnesium-sinkki-TC- perusteinen luuta parantava materiaali
- matrisellulaarinen
- matrix
- mekanosensorinen
- menakinonilajit) ja diabetes
- metallinkuljettaja
- Metastaattinen luustosairaus
- Mineraalifaasi
- MiRNA-4287 ja chondogenesis
- MMP
- MMP-13
- MPDZ
- MSC
- Multipplit kylkiluumurtumat ja epästabliili rintakehä (väitöskirja)
- Munuaiskivistä
- Myokiini irisiini.
- MZ-TC scaffold
- N-Bps
- natrium
- Naudan maksan KI2 vitamiinit
- NCP
- neuraalipoimu
- Neuropiliini-1
- NFkB
- Nivelrustosta pohdittavaksi
- Non-union
- NTPDase-1
- nukleaatio
- Nukleobindiini (NUC)
- Numb-binding protein X2
- OC
- OCIF
- OCN
- odontoblasti
- odontoblastiulokkeet
- Olkavarren yläosan murtuman aiempia ja uusimpia korjaustekniikoita
- Olkavarren yläosan murtuman eräs korjaustapa
- ONJ
- OP ja bifosfonaatit
- OPG
- OPG/RANKL/RANK
- orgaaninen
- Os scaphoideum
- Osteoartriitti
- Osteoblasti
- osteoclastogeneesin estäjä
- osteogeneesi
- osteogenesis imperfecta
- osteoidi
- Osteoimmunologia
- Osteokalsiini
- osteokalsiini OC
- Osteoklasti
- Osteoklasti ja kloridi
- osteoklastit
- osteoklastogeneesin esto
- Osteomyeliittiongelmasta ja hoitoon soveltuvista biomateriaaleista
- osteonekroosi
- Osteonektiini
- osteopetrosis
- Osteopontiini(OP)
- osteoporosis
- osteoprogeniittorisolu
- Osteoprotegeriini
- Osteoprotegeriini (OPG)
- osteosyytti
- p53
- pamidronaatti
- parodontitis (Duodecim)
- PDZK4
- PDZRN1
- PDZRN2
- PDZRN3
- PDZRN4
- PDZRN4L
- pentosidiini
- periosteum (luukalvo)
- Periprosteettinen osteolyysi
- PGE2
- Pi:PPi
- Plexiini-A1
- PMMA luusementtiaineen uusista jatkokehittelyistä ja indikaatioista
- POLVI
- Polvihematoma
- Poly-epsilon-kaprolaktoni
- posttranslationaali modifikaatio
- PPi
- predentiini
- predentiinit
- Prepatellaari bursiitti
- primäärikide
- proteesist
- proteiinin geranylgeranylaation inhibitio
- pseudoartroosi
- PTH
- pulpa
- puristus( kompressio)
- PYK2 geenin osuus luun uudismuodostuksessa ym
- pyrofosfaatti
- rajapintasolut
- Randallin plakit
- Rangan ja rungon treenaus sekä RANKL
- RANK
- RANK/RANKL/OPG
- RANKL
- RANKL/RANK
- Rasvadieetti ja luu
- Remodeling ja MMP-13
- RGD
- S1P ja reseptorit S1PR2 ja S1PR2
- Samuel Bagster 1875
- Sanasto
- SARS.1 ja steroidiläkityksen vaarat
- sclerostiini
- Secreted protein Acidic Cys Rich
- SEMA3A
- Semaforiini 4A ja osteoartroosi
- Semaforiinit luun homeostaasissa (2013 artikkeli)
- SEMCAP3
- Sharpeyn säikeet
- Sharpeyn säikeet (SF)
- Shearer MJ: K-vitamiini ja luusto
- SIBLING-perhe
- sitaattia
- sklerostiini
- sklerostiinivasta-aine
- Smad ja osteoporosis
- SNS
- Somogyi-Ganss
- SOST . Sclerosteosis
- SOST (17q21.31)
- SOST geenituotteesta sklerostiinista uutta tietoa 2017
- SOST gene
- SPARC
- Stafylokokin pitkät menakinonit
- Strontium
- SuomalaisenJaakobin painia . Honkonen Nyman 2020 Nivusalueen kivuista.
- Suomen lonkkamurtumatilanteesta
- Suoniston kalkkeutuminen
- suuret käsivammat
- Synoviumin proteiini
- Synteettisistä rustomateriaaleista
- sytokiini
- sytokiinireseptori
- syövän merkitsijä
- taivutus( bending) kiertokuormitus( torsio)
- tenaskiini
- Tenaskiini-W
- Tenaskiinit
- Terminologiaa K-vitamiinista ja analogeista
- TGF-beta
- THBS2
- Thesis
- Thorborg K et al.2018 nivusalueen kiputiloista urheilijoilla
- TNF
- TNFalfa
- TNFRSFIIB
- TNFSF11 (13q14.11)
- TRAIL
- TRAP
- TRAPcP5b
- Trikalsiumfosfaatti TCP
- Trombospondiini
- trombospondiinit
- TSP1 angiogenesis 15q15
- TSP2 synaptogenesis 6q27
- TSP4 jännelihasliitos 5q13
- typpipitoinen bifosfonaatti
- UFM1 ja ufmylaatio- systeemi on ylössäätyny tER stressissä osteogeenisen erilasitumsien aikana
- ufntkaation välttämättömyys sikiönkehitykselle. ja oteogeeniselle erilaistumiselle
- UO2(2+) uranyyli
- UPS ja DUBs
- Uusi hoitoperiaate reumaan
- Uusi väitöskirja
- Uutta osteoporoosilääkettä tiatsideista
- valenivel
- VBCH
- veneluu ranteessa
- venytys (tensio)
- virkoelastisuus
- Väitöskirja
- Väitöskirja luun mineralisaation kontrollista (2003)
- Väitöskirjoja
- warfariini
- Wnt
- Wnt16
- zoledronaatti
- Zoledronaatti)
onsdag 22 oktober 2014
Hydroxyapatiitti tietokoneella
Luonnollisen luun ja hampaan pääasiallisin mineraalifaasi on karbonoitunut hydroxiapatiitti.
Carbonated hydroxyapatite is the major mineral phase in natural bone and teeth and is therefore an attractive material for use in tissue replacement applications. However, its successful application as a biomaterial requires a detailed understanding of its bulk and surface structures, defect chemistry, growth and dissolution behaviour and interaction with complex biomolecules
. Computer modelling can aid experiment by investigating at the atomic level highly complex structures, properties and processes, which are still difficult or impossible to access with experimental techniques. Here, we describe our use of a combination of complementary computational techniques to investigate a number of topical issues relevant to the use of hydroxyapatite in biomaterials applications, including the bulk and surface structures of the pure material; the structure and location of carbonate impurities in the lattice; the uptake of fluoride and its effect on hydroxyapatite dissolution; and crystal growth inhibition by citric acid.
Carbonated hydroxyapatite is the major mineral phase in natural bone and teeth and is therefore an attractive material for use in tissue replacement applications. However, its successful application as a biomaterial requires a detailed understanding of its bulk and surface structures, defect chemistry, growth and dissolution behaviour and interaction with complex biomolecules
. Computer modelling can aid experiment by investigating at the atomic level highly complex structures, properties and processes, which are still difficult or impossible to access with experimental techniques. Here, we describe our use of a combination of complementary computational techniques to investigate a number of topical issues relevant to the use of hydroxyapatite in biomaterials applications, including the bulk and surface structures of the pure material; the structure and location of carbonate impurities in the lattice; the uptake of fluoride and its effect on hydroxyapatite dissolution; and crystal growth inhibition by citric acid.

Hampaanpoiston jälkeen. Luunmurtuman paraneminen
LÄHDE: Cardemil C. Bone repai
rIn: Effects of antiresorptive agents on inflammation and bone regeneration..p. 10-12 ( 2014 Thesis)
Hampaanpoiston jälkeen muodostavat verisolut ja fibriini hyytymän. Fibriini on proteiini, joka osallistuu veren hemostaasiin. Seuraavien 4- 5 päivän aikana hyytymä korvautuu granulaatiokudoksella, jossa on punasoluja, valkosoluja ja endoteelisoluja. Kolmannessa vaiheessa granulaatiokudos korvautuu sidekudoksella 14- 16 päivän jakson aikana. Luunmuodostuminen alkaa seitsemän päivän päästä osteoidin muodostumisella alveolikuopan pohjalta ja periferiasta kuoppa täyttyy hohkaluulla 38 päivän mentyä , pian sen jälkeen kun epiteeli on sulkeutunut 24.- 35. päivänä
Luunmurtuman korjautumisessa luun reduktio ja luufragmenttien fixaatio ovat ensiarvoisen tärkeitä, jotta saadaan optimaalinen murtuman parantuminen aikaan. ( Pyrkimys raajan normaaliasentoon ja murtuman päitten saamiseen vastakkain)
Murtuman parantumisessa on kolme vaihetta:
(1) tulehdus, (2) korjaantuminen ja (3) remodelaatio.
Kun verisuonet repeytyvät, ilmenee vasodilataatiota ( suonten laajenemista) ja plasman exudaatiota ( nesteen tihkumista paikalle) sekä valkosoluja, ja luun murtuneet päätteet menevät nekroosiin.
Calluksen muodostuminen:

Murtumarako täyttyy fibriinistä ja muodostuu hematooma, jonka piirteenä on matala pH ja hypoksia. Hematoma sisältää proinflammatorisia ja anti-inflammatorisia sytokiinejä ja runsaasti valkosoluja. Tähän callus-muodostumaan invasoituu ensiksi polymorfisia neutrofiilejä (PMN) ja naitten kintereillä makrofageja sekä T- ja B-imosoluja 8lymfosyyttejä) .
Kuolleet solut ja debrismateriaali houkuttelevät paikalle neutrofiilejä, jotka lyhyenä elossaoloaikanaan erittävät kemokiinejä (chemokines) kuten IL-6, (interleukiini 6). Se taas attrahoi makrofageja ja lymfosyyttejä (imusoluja) callus-alueelle.
Tulehdusvaiheessa erittyviä muita pro-inflammatorisia sytokiineja ovat IL-1, TNF, RANKL, M-CSF-1 ( makrofaagiklooneja stimuloiva tekijä 1) , TGF-beeta ( transformoivan kasvutekijän beeta) suurperheen jäseniä kuten BMP proteiinit ( luun morfogeneettiset proteiinit) .
Hypoksisesta olosuhteesta johtuen vapautuu angiogeenisiä tekijöitä kuten vaskulaarista endoteelistä kasvutekijää (VEGF) ja siitä seuraa endoteelisolujen migroituminen periosteumin suonista tähän hematomaan tekemään siihen uusia verisuonia.
Fibroblastit tuottavat uutta kollageeniä (COL) , hematooman sijaan tulee granulaatiokudosta ja mesenkymaalisten kantasoujen (MSC) erilaistuminen osteoblasteiksi edistyy..
Murtuma-alueen vakinaiset makrofagit ovat keskeisiä peiteluitten ( intramembranous bone) muodostumisess, kun taas tulehdukselliset makrofagit joita rekrytoituu murtumakohtaan vaikuttavat rustosyntyistä ( endochondral bone) luutumista .
On neljän tyyppistä luun paranemista
https://www2.aofoundation.org/wps/portal/surgerymobile?contentUrl=/srg/popup/further_reading/PFxM2/12_33_biol_fx_heal.jsp&soloState=precomp&title=&Language=en
(1) endochondraalinen, luun korjaantuminen rustovaiheen kautta
(2) primääri luun korjaantuminen
(3) suora luun korjaantumine
(4) distraktio-osteogenesis ., venytysluudutus( kirurginen; http://www.duodecimlehti.fi/web/guest/arkisto?p_p_id=Article_WAR_DL6_Articleportlet&p_p_action=1&p_p_state=maximized&p_p_mode=view&p_p_col_id=column-1&p_p_col_count=1&viewType=viewArticle&tunnus=duo98528 )
Endochondraalinen luun korjaantuminen tapahtuu, kun stabiliteetti on matala-asteista. Alkuvaiheen pehmeä callus transformoituu - luucallukseksi.. Periosteaaliset edeltäjäsolut erilaistuvat osteoblasteiksi, mikä aloittaa intramembraanisen luun muodostumisen ja sitä seuraa edelleen calluskasvua kondrosyyttien (rustosolujen) avulla, jotka muodostavat rustoa ( cartilago), jota ympäröi sidekudos ja granulaatiokudos. 10-14 päivän päästä kondrosyytit tulevat hypertroofisiksi ja menevät apoptoosiin. Rusto hypervaskularisoituu ja rekrytoituneet mesenkyymikantasolut (MSC) ja monosyytit erilaistuvat : edelliset osteoblasteiksi ja jälkimmäiset osteoklasteiksi. Kun kalkkeutunut rusto on resorboitunut, muodostuu uutta luukudosta, joka on hohkaluuta (trabecular bone) ja kun luusiltaa on, sidekudos ja granulaatiokudos korvaamtuvat intramebraanilla kalvonvälisellä luunmuodostuksella . Kun murtumarako on uuden luun täyttämä, osteoklastit alkavat resorboida periostaalista callusmuodostumaa ja luukudos remodeloituu lamellaariseksi (säleiseksi) luuksi kuoriluun murtuma-raossa ja sen jälkeen resorptio ja remodelaatio jatkuvat ytimen calluksessa.
Primääri luun korjaantuminen tapahtuu kuoriluussa (cortical bone) , kun on suora kontakti ja tukevan stabiili tilanne. Osteoclastit resorboivat luuta murtumaraon molemmin puolin. leikkaavin kartioin ja täten ne tekevät mahdolliseksi verisuonten kasvamisen callukseen ja niitä seuraa edeltäjäsolut, jotka erilaistuvat osteoblasteiksi. Ne syntetisoivat lamellaarista (säleistä) luuta, joka taas ei tarvitse remodelaatiota.
Suora luun korjaantuminen välittyy ilman rustoa verisuonten ja mesenkymaalisten solujen avulla, jotka ovat luuydinperäisiä. Nämä solut erilaistuvat ja syntetisoivat luukudosta ja lamellaarista luuta ja remodelaatio tapahtuu luun pituusakselin suuntaan. Tämän tyyppinen luun korjaantuminen tapahtuu, kun fragmenttiväli on suurempi kuin 0,1 mm ja fixaatio on tukeva.
Distraction osteogenesis, venytysluuduts on kirurginen, stimuloi luutumista ja välittyy periosteumin, endosteumin ja luuytimen kautta., jossa luukudosta ja lamellaarista luuta tuottuu laajemmaksi venytettyyn murtumarakoon.
rIn: Effects of antiresorptive agents on inflammation and bone regeneration..p. 10-12 ( 2014 Thesis)
Suomennosta
Luun paranemisesta
Amler et al. jo kuvasivat perusteellisesti 1960 hampaanpoiston yhteydessä tapahtuvaa haavan paranemisprosessiaHampaanpoiston jälkeen muodostavat verisolut ja fibriini hyytymän. Fibriini on proteiini, joka osallistuu veren hemostaasiin. Seuraavien 4- 5 päivän aikana hyytymä korvautuu granulaatiokudoksella, jossa on punasoluja, valkosoluja ja endoteelisoluja. Kolmannessa vaiheessa granulaatiokudos korvautuu sidekudoksella 14- 16 päivän jakson aikana. Luunmuodostuminen alkaa seitsemän päivän päästä osteoidin muodostumisella alveolikuopan pohjalta ja periferiasta kuoppa täyttyy hohkaluulla 38 päivän mentyä , pian sen jälkeen kun epiteeli on sulkeutunut 24.- 35. päivänä
Luunmurtuman korjautumisessa luun reduktio ja luufragmenttien fixaatio ovat ensiarvoisen tärkeitä, jotta saadaan optimaalinen murtuman parantuminen aikaan. ( Pyrkimys raajan normaaliasentoon ja murtuman päitten saamiseen vastakkain)
Murtuman parantumisessa on kolme vaihetta:
(1) tulehdus, (2) korjaantuminen ja (3) remodelaatio.
Kun verisuonet repeytyvät, ilmenee vasodilataatiota ( suonten laajenemista) ja plasman exudaatiota ( nesteen tihkumista paikalle) sekä valkosoluja, ja luun murtuneet päätteet menevät nekroosiin.
Calluksen muodostuminen:

Murtumarako täyttyy fibriinistä ja muodostuu hematooma, jonka piirteenä on matala pH ja hypoksia. Hematoma sisältää proinflammatorisia ja anti-inflammatorisia sytokiinejä ja runsaasti valkosoluja. Tähän callus-muodostumaan invasoituu ensiksi polymorfisia neutrofiilejä (PMN) ja naitten kintereillä makrofageja sekä T- ja B-imosoluja 8lymfosyyttejä) .
Kuolleet solut ja debrismateriaali houkuttelevät paikalle neutrofiilejä, jotka lyhyenä elossaoloaikanaan erittävät kemokiinejä (chemokines) kuten IL-6, (interleukiini 6). Se taas attrahoi makrofageja ja lymfosyyttejä (imusoluja) callus-alueelle.
Tulehdusvaiheessa erittyviä muita pro-inflammatorisia sytokiineja ovat IL-1, TNF, RANKL, M-CSF-1 ( makrofaagiklooneja stimuloiva tekijä 1) , TGF-beeta ( transformoivan kasvutekijän beeta) suurperheen jäseniä kuten BMP proteiinit ( luun morfogeneettiset proteiinit) .
Hypoksisesta olosuhteesta johtuen vapautuu angiogeenisiä tekijöitä kuten vaskulaarista endoteelistä kasvutekijää (VEGF) ja siitä seuraa endoteelisolujen migroituminen periosteumin suonista tähän hematomaan tekemään siihen uusia verisuonia.
Fibroblastit tuottavat uutta kollageeniä (COL) , hematooman sijaan tulee granulaatiokudosta ja mesenkymaalisten kantasoujen (MSC) erilaistuminen osteoblasteiksi edistyy..
Murtuma-alueen vakinaiset makrofagit ovat keskeisiä peiteluitten ( intramembranous bone) muodostumisess, kun taas tulehdukselliset makrofagit joita rekrytoituu murtumakohtaan vaikuttavat rustosyntyistä ( endochondral bone) luutumista .
On neljän tyyppistä luun paranemista
https://www2.aofoundation.org/wps/portal/surgerymobile?contentUrl=/srg/popup/further_reading/PFxM2/12_33_biol_fx_heal.jsp&soloState=precomp&title=&Language=en
(1) endochondraalinen, luun korjaantuminen rustovaiheen kautta
(2) primääri luun korjaantuminen
(3) suora luun korjaantumine
(4) distraktio-osteogenesis ., venytysluudutus( kirurginen; http://www.duodecimlehti.fi/web/guest/arkisto?p_p_id=Article_WAR_DL6_Articleportlet&p_p_action=1&p_p_state=maximized&p_p_mode=view&p_p_col_id=column-1&p_p_col_count=1&viewType=viewArticle&tunnus=duo98528 )
Endochondraalinen luun korjaantuminen tapahtuu, kun stabiliteetti on matala-asteista. Alkuvaiheen pehmeä callus transformoituu - luucallukseksi.. Periosteaaliset edeltäjäsolut erilaistuvat osteoblasteiksi, mikä aloittaa intramembraanisen luun muodostumisen ja sitä seuraa edelleen calluskasvua kondrosyyttien (rustosolujen) avulla, jotka muodostavat rustoa ( cartilago), jota ympäröi sidekudos ja granulaatiokudos. 10-14 päivän päästä kondrosyytit tulevat hypertroofisiksi ja menevät apoptoosiin. Rusto hypervaskularisoituu ja rekrytoituneet mesenkyymikantasolut (MSC) ja monosyytit erilaistuvat : edelliset osteoblasteiksi ja jälkimmäiset osteoklasteiksi. Kun kalkkeutunut rusto on resorboitunut, muodostuu uutta luukudosta, joka on hohkaluuta (trabecular bone) ja kun luusiltaa on, sidekudos ja granulaatiokudos korvaamtuvat intramebraanilla kalvonvälisellä luunmuodostuksella . Kun murtumarako on uuden luun täyttämä, osteoklastit alkavat resorboida periostaalista callusmuodostumaa ja luukudos remodeloituu lamellaariseksi (säleiseksi) luuksi kuoriluun murtuma-raossa ja sen jälkeen resorptio ja remodelaatio jatkuvat ytimen calluksessa.
Primääri luun korjaantuminen tapahtuu kuoriluussa (cortical bone) , kun on suora kontakti ja tukevan stabiili tilanne. Osteoclastit resorboivat luuta murtumaraon molemmin puolin. leikkaavin kartioin ja täten ne tekevät mahdolliseksi verisuonten kasvamisen callukseen ja niitä seuraa edeltäjäsolut, jotka erilaistuvat osteoblasteiksi. Ne syntetisoivat lamellaarista (säleistä) luuta, joka taas ei tarvitse remodelaatiota.
Suora luun korjaantuminen välittyy ilman rustoa verisuonten ja mesenkymaalisten solujen avulla, jotka ovat luuydinperäisiä. Nämä solut erilaistuvat ja syntetisoivat luukudosta ja lamellaarista luuta ja remodelaatio tapahtuu luun pituusakselin suuntaan. Tämän tyyppinen luun korjaantuminen tapahtuu, kun fragmenttiväli on suurempi kuin 0,1 mm ja fixaatio on tukeva.
Distraction osteogenesis, venytysluuduts on kirurginen, stimuloi luutumista ja välittyy periosteumin, endosteumin ja luuytimen kautta., jossa luukudosta ja lamellaarista luuta tuottuu laajemmaksi venytettyyn murtumarakoon.
Luun aineenvaihdunnan systeeminen säätyminen (C Cardemil, 2014)
LÄHDE:
Cardemil C. Systemic regulation of bone metabolism. In: Effects of antiresorptive agents on inflammation and bone regeneration..p. 9-10 ( 2014 Thesis)
Suomennosta
Usea endokriininen tie kontrolloi luun aineenvaihduntaa ja säätelee mineraalien sekä glukoosin homeostaasia.
Niissä tekijöissä, jotka kontrolloivat mineraalien homeostaasia, on
D-vitamiinia muodostuu ihossa auringonvalon vaikutuksesta ja silloin esimutoinen D2 vitamiini muuttuu D3- vitamiiniksi kehon lämmöstä ja tämä vitamiinimuoto muuttuu edelleen maksassa 25- hydroxyvitamiiniksi
(25(OH)D3). Munuaisessa se muuttuu metabolisesti aktiiviksi vitamiini D hormoniksi 1,25(OH)2D3.

Jos lisäkilpirauhasessa sijaitseva kalsiumia tunnistava reseptori havaitsee seerumin kalsiumpitoisuuden olevan matala, stimuloituu rauhasesta esiin lisäkilpirauhashormonia (PTH).

Sitten PTH vuorostaan stimuloi osteoklastien tekemää luun resorboimista, kalsiumin imeytymistä munuaisista ja munuaisten 1,25(OH)2D3- tuotantoa, jonka toimesta suolesta imeytyisi enemmän kalsiumia vereen ja näin lisääntyy seerumin kalsiumpitoisuus.
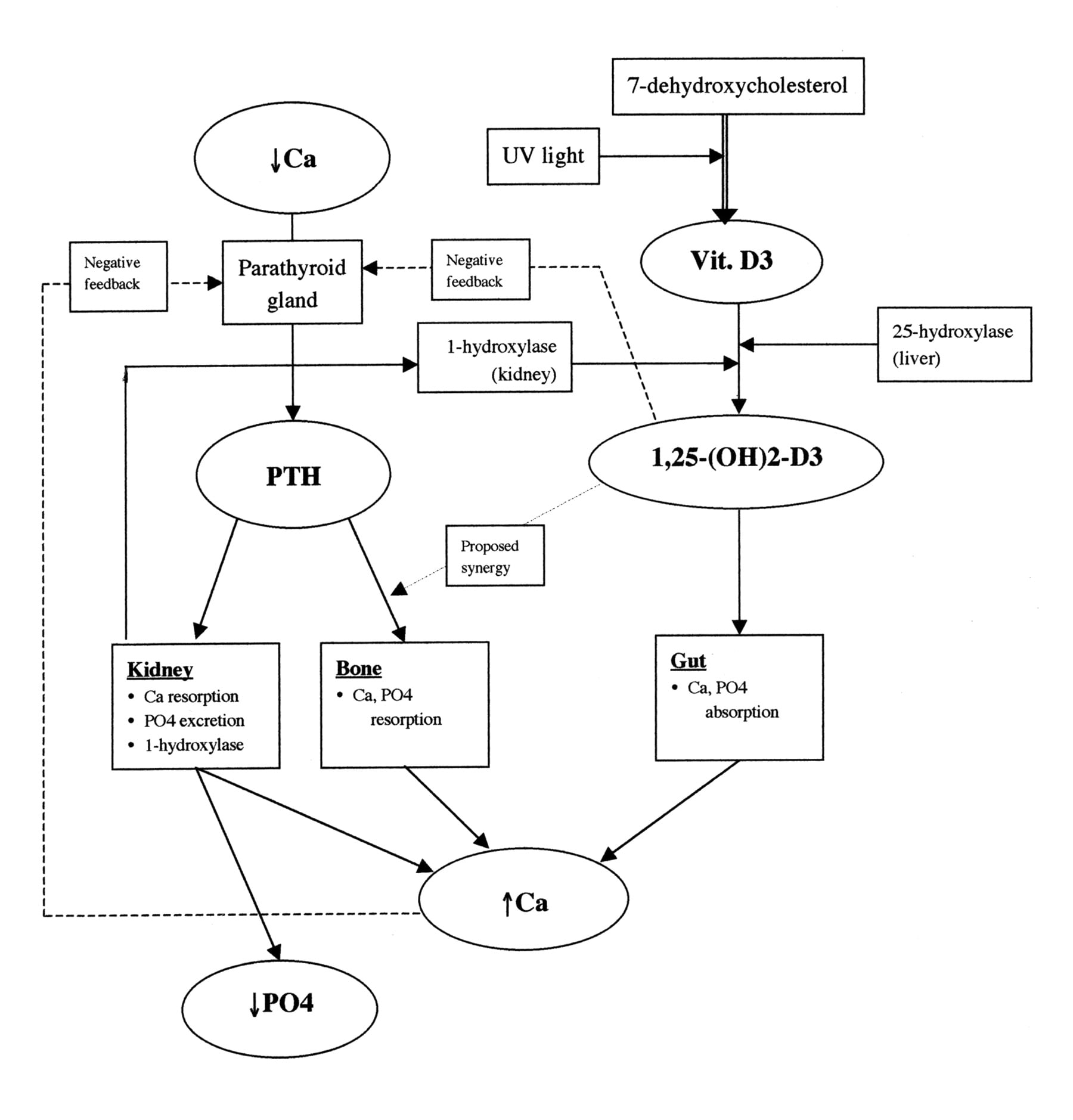
Jos seerumin fosfaattipitoisuudet ja 1,25(OH)2D3 pitoisuudet ovat koholla , luussa (osteosyyteissä) stimuloituu esiin FGF23 tuotanto, mikä puolestaan estää lisäkilpirauhashormonin (PTH) tuotoa ja metabolisesti aktiivin D- vitamiinin 1,25(OH)2D3 muodostumista. ja niin myös estyy suolesta tapahtuva kalsiumin imeytyminen. Näiden lisäksi stimuloituu fosfaatin erittyminen munuaisista.
http://rimg.geoscienceworld.org/content/64/1/223.extract

Leptiini (LEP) on peptidihormoni, jota rasvasolut, adiposyytit, tuottavat ja uskotaan sillä olevan säätelevää vaikutusta luun massaan, vaikkakin leptiinin täsmä roolista luussa vielä väitellään.
On kaksi päähypoteesiä leptiinin suorittamasta luun säätelystä:
(1) luunmuodostuksen epäsuora vaimentaminen (suppressio) hypotalamuksen kautta lisäämällä sympaattisen hermojärjestelmän (SNS) signalointia serotoniinisynteesin (5-HT) suppressiolla, vaimennuksella,
ja
(2) suora positiivinen vaikutus lisäämällä osteoblastien proliferaatiota ja differentiaatiota.

Lisäksi sympaattisen hermojärjestelmän (SNS) lisääntynyt signalointi lisää osteokalsiinin (OC) tuotantoa osteoblasteista ja osteosyyteistä , mikä puolestaan stimuloi haiman beeta-soluja lisäämään insuliinintuotantoaan, mikä taas stimuloi osteoblasteja ja niiden osteokalsiinin (OC) tuotantoa.
Osteoblastien insuliinisignalointi edistää myös luun resorptiota alentamalla osteoprotegeriinin (OPG) ilmenemistä täten stimuloiden osteoklastogeneesiä.
Edelleen osteokalsiini (OC) stimuloi adiposyyttejä tuottamaan adiponektiiniä, insuliiniherkkää hormonia.
Estrogeeni ja androgeeni omaavat vahvoja vaikutuksia luuston kasvuun ja ne osallistuvat myös luuston homeostaasiin.
Estrogeeni estää luukatoa lisäämällä osteoprotegeriinin (OPG) ilmenemistä osteoblasteissa ja vähentämällä RANKL:in ja TNF-alfan ilmenemistä. Estrogeeni vaikuttaa luitten pituuskasvuun, sillä pienissä pitoisuuksissa estrogeeni tehostaa luuston kasvua ja suuret pitoisuudet johtavat kasvulevyjen fuusioon.
Estrogeenit ovat myös tehokkaita säätelijöitä kasvuhormonille (GH) ja insuliinin kaltaiselle kasvutekijälle 1 (IGF-1). Oletetaan myös, että estrogeeni indusoi prekursorisolujen erilaistumista osteoblasteiksi adiposyyttien erilaistumisen kustannuksella estäen täten osteoblastien apoptoitumista.
Sukupuolihormonien reseptorit omaavat erilaiset tehtävät HOHKALUUN (trabecular bone) ja KUORILUUN (cortical bone) alueella. Vasteet kasvuhormonien, hormonien ja mekaanisen rasituksen muutoksille ovat myös erilaiset pitkien luitten PERIOSTEUM ja ENDOSTEUM -pinnoilla.
ERalfa, estrogeenin reseptori alfa, on luussa kaikkein tärkein estrogeenin vaikutusten välittäjä.
Alentuneeseen HOHKALUUN (trabecular bone) resorptioon johtaa estrogeenin suorat vaikutukset osteoklasteihin ja suorat tai epäsuorat vaikutukset B-lymfosyytteihin, joita vaikutuksia välittää ERalfa.
KUORILUUN ( Cortical bone) massaa estrogeeni suojaa epäsuorasti osteoblastiprogeniittoreitten ERalfa- reseptorin kautta heikentämällä luun reorptiota endokortikaalisilla pinnoilla.
Osteoblastein androgeenireseptori (AR) on välttämätön miesten HOHKALUUN (trabecular bone) ylläpidossa.
LRP-5-Wnt-beeta -kateniini signalointitien aktivoituminen vaaditaan luun fysiologisessa vasteessa mekaaniseen rasitukseen.
LRP-5 on Low-density lipoprotein receptor- related protein 5.
ERalfa on osoittautunut Wnt- signalontia vahvistavaksi osteoblasti-progeniittorisoluissa.
Iän mukana osteoblastien vastaavuus mekaaniseen stimulukseen alenee, mikä saattaa johtua menopaussissa tapahtuvasta estrogeenin kadosta, koska ERalfa säätyy alas.
Päivitys 20.1. 2017
LÄHDE: Väitöskirja Carina Cardemil: Effects of antiresorptive agents on inflammation and bone regeneration in different osseus sites- experimental and clinical studies. University of Gothenburg. ISBN 978-91-628-9108-4.
Kappale Systemic regulation of bone metabolism sivut 9-10.Suomennosta.
Cardemil C. Systemic regulation of bone metabolism. In: Effects of antiresorptive agents on inflammation and bone regeneration..p. 9-10 ( 2014 Thesis)
Suomennosta
Luun aineenvaihdunnan systeeminen säätely ( C. Cardemil: Systemic regulation of bone metabolism)
Usea endokriininen tie kontrolloi luun aineenvaihduntaa ja säätelee mineraalien sekä glukoosin homeostaasia.
Niissä tekijöissä, jotka kontrolloivat mineraalien homeostaasia, on
- lisäkilpirauhashormoni, (Parathyreoid hormone, PTH),
- Vitamiini D hormoni (1,25(OH)2D)
- fibroblastien kasvutekijä 23 (FGF23), jota osteosyytti tuottaa.
- leptiini (LEP),
- sympaattinen hermosto (SNS),
- osteokalsiini(OC)
- insuliini.
D-vitamiinia muodostuu ihossa auringonvalon vaikutuksesta ja silloin esimutoinen D2 vitamiini muuttuu D3- vitamiiniksi kehon lämmöstä ja tämä vitamiinimuoto muuttuu edelleen maksassa 25- hydroxyvitamiiniksi
(25(OH)D3). Munuaisessa se muuttuu metabolisesti aktiiviksi vitamiini D hormoniksi 1,25(OH)2D3.

Jos lisäkilpirauhasessa sijaitseva kalsiumia tunnistava reseptori havaitsee seerumin kalsiumpitoisuuden olevan matala, stimuloituu rauhasesta esiin lisäkilpirauhashormonia (PTH).
Sitten PTH vuorostaan stimuloi osteoklastien tekemää luun resorboimista, kalsiumin imeytymistä munuaisista ja munuaisten 1,25(OH)2D3- tuotantoa, jonka toimesta suolesta imeytyisi enemmän kalsiumia vereen ja näin lisääntyy seerumin kalsiumpitoisuus.

Jos seerumin fosfaattipitoisuudet ja 1,25(OH)2D3 pitoisuudet ovat koholla , luussa (osteosyyteissä) stimuloituu esiin FGF23 tuotanto, mikä puolestaan estää lisäkilpirauhashormonin (PTH) tuotoa ja metabolisesti aktiivin D- vitamiinin 1,25(OH)2D3 muodostumista. ja niin myös estyy suolesta tapahtuva kalsiumin imeytyminen. Näiden lisäksi stimuloituu fosfaatin erittyminen munuaisista.
http://rimg.geoscienceworld.org/content/64/1/223.extract

Leptiini (LEP) on peptidihormoni, jota rasvasolut, adiposyytit, tuottavat ja uskotaan sillä olevan säätelevää vaikutusta luun massaan, vaikkakin leptiinin täsmä roolista luussa vielä väitellään.
On kaksi päähypoteesiä leptiinin suorittamasta luun säätelystä:
(1) luunmuodostuksen epäsuora vaimentaminen (suppressio) hypotalamuksen kautta lisäämällä sympaattisen hermojärjestelmän (SNS) signalointia serotoniinisynteesin (5-HT) suppressiolla, vaimennuksella,
ja
(2) suora positiivinen vaikutus lisäämällä osteoblastien proliferaatiota ja differentiaatiota.

Lisäksi sympaattisen hermojärjestelmän (SNS) lisääntynyt signalointi lisää osteokalsiinin (OC) tuotantoa osteoblasteista ja osteosyyteistä , mikä puolestaan stimuloi haiman beeta-soluja lisäämään insuliinintuotantoaan, mikä taas stimuloi osteoblasteja ja niiden osteokalsiinin (OC) tuotantoa.
Osteoblastien insuliinisignalointi edistää myös luun resorptiota alentamalla osteoprotegeriinin (OPG) ilmenemistä täten stimuloiden osteoklastogeneesiä.
Edelleen osteokalsiini (OC) stimuloi adiposyyttejä tuottamaan adiponektiiniä, insuliiniherkkää hormonia.
Estrogeeni ja androgeeni omaavat vahvoja vaikutuksia luuston kasvuun ja ne osallistuvat myös luuston homeostaasiin.
Estrogeeni estää luukatoa lisäämällä osteoprotegeriinin (OPG) ilmenemistä osteoblasteissa ja vähentämällä RANKL:in ja TNF-alfan ilmenemistä. Estrogeeni vaikuttaa luitten pituuskasvuun, sillä pienissä pitoisuuksissa estrogeeni tehostaa luuston kasvua ja suuret pitoisuudet johtavat kasvulevyjen fuusioon.
Estrogeenit ovat myös tehokkaita säätelijöitä kasvuhormonille (GH) ja insuliinin kaltaiselle kasvutekijälle 1 (IGF-1). Oletetaan myös, että estrogeeni indusoi prekursorisolujen erilaistumista osteoblasteiksi adiposyyttien erilaistumisen kustannuksella estäen täten osteoblastien apoptoitumista.
Sukupuolihormonien reseptorit omaavat erilaiset tehtävät HOHKALUUN (trabecular bone) ja KUORILUUN (cortical bone) alueella. Vasteet kasvuhormonien, hormonien ja mekaanisen rasituksen muutoksille ovat myös erilaiset pitkien luitten PERIOSTEUM ja ENDOSTEUM -pinnoilla.
ERalfa, estrogeenin reseptori alfa, on luussa kaikkein tärkein estrogeenin vaikutusten välittäjä.
Alentuneeseen HOHKALUUN (trabecular bone) resorptioon johtaa estrogeenin suorat vaikutukset osteoklasteihin ja suorat tai epäsuorat vaikutukset B-lymfosyytteihin, joita vaikutuksia välittää ERalfa.
KUORILUUN ( Cortical bone) massaa estrogeeni suojaa epäsuorasti osteoblastiprogeniittoreitten ERalfa- reseptorin kautta heikentämällä luun reorptiota endokortikaalisilla pinnoilla.
Osteoblastein androgeenireseptori (AR) on välttämätön miesten HOHKALUUN (trabecular bone) ylläpidossa.
LRP-5-Wnt-beeta -kateniini signalointitien aktivoituminen vaaditaan luun fysiologisessa vasteessa mekaaniseen rasitukseen.
LRP-5 on Low-density lipoprotein receptor- related protein 5.
ERalfa on osoittautunut Wnt- signalontia vahvistavaksi osteoblasti-progeniittorisoluissa.
Iän mukana osteoblastien vastaavuus mekaaniseen stimulukseen alenee, mikä saattaa johtua menopaussissa tapahtuvasta estrogeenin kadosta, koska ERalfa säätyy alas.
Päivitys 20.1. 2017
LÄHDE: Väitöskirja Carina Cardemil: Effects of antiresorptive agents on inflammation and bone regeneration in different osseus sites- experimental and clinical studies. University of Gothenburg. ISBN 978-91-628-9108-4.
Kappale Systemic regulation of bone metabolism sivut 9-10.Suomennosta.
tisdag 21 oktober 2014
Pohdinta Sharpeyn säikeitten merkityksestä : Onko kyse uudesta luumatrixin säätelyjärjestelmästä?
- Front Endocrinol (Lausanne). 2012 Aug 9;3:98. doi: 10.3389/fendo.2012.00098. eCollection 2012. Periosteal Sharpey's fibers: a novel bone matrix regulatory system?
Sharpey's
"perforating" fibers (SF) are well known skeletally in tooth anchorage.
Elsewhere they provide anchorage for the periosteum and are less well
documented.
Immunohistochemistry has transformed their potential significance by identifying their collagen type III (CIII) content and enabling their mapping in domains as permeating arrays of fibers (5-25 μ thick), protected from osteoclastic resorption by their poor mineralization.
As periosteal extensions they are crucial in early skeletal development and central to intramembranous bone healing, providing unique microanatomical avenues for musculoskeletal exchange, their composition (e.g., collagen type VI, elastin, tenascin) combined with a multiaxial pattern of insertion suggesting a role more complex than attachment alone would justify.
A proportion permeate the cortex to the endosteum (and beyond), fusing into a CIII-rich osteoid layer (<2 μ thick) encompassing all resting surfaces, and with which they apparently integrate into a
PERIOSTEAL-SHARPEY FIBER-ENDOSTEUM (PSE) structural continuum.
This intraosseous system behaves in favor of bone loss or gain depending upon extraneous stimuli (i.e., like Frost's hypothetical "mechanostat"). Thus, the birefringent fibers are sensitive to humoral factors (e.g., estrogen causes retraction, rat femur model), physical activity (e.g., running causes expansion, rat model), aging (e.g., causes fragmentation, pig mandible model), and pathology (e.g., atrophied in osteoporosis, hypertrophied in osteoarthritis, human proximal femur), and with encroaching mineral particles hardening the usually soft parts. In this way the unobtrusive periosteal SF network may regulate bone status, perhaps even contributing to predictable "hotspots" of trabecular disconnection, particularly at sites of tension prone to fatigue, and with the network deteriorating significantly before bone matrix loss.
Immunohistochemistry has transformed their potential significance by identifying their collagen type III (CIII) content and enabling their mapping in domains as permeating arrays of fibers (5-25 μ thick), protected from osteoclastic resorption by their poor mineralization.
As periosteal extensions they are crucial in early skeletal development and central to intramembranous bone healing, providing unique microanatomical avenues for musculoskeletal exchange, their composition (e.g., collagen type VI, elastin, tenascin) combined with a multiaxial pattern of insertion suggesting a role more complex than attachment alone would justify.
A proportion permeate the cortex to the endosteum (and beyond), fusing into a CIII-rich osteoid layer (<2 μ thick) encompassing all resting surfaces, and with which they apparently integrate into a
PERIOSTEAL-SHARPEY FIBER-ENDOSTEUM (PSE) structural continuum.
This intraosseous system behaves in favor of bone loss or gain depending upon extraneous stimuli (i.e., like Frost's hypothetical "mechanostat"). Thus, the birefringent fibers are sensitive to humoral factors (e.g., estrogen causes retraction, rat femur model), physical activity (e.g., running causes expansion, rat model), aging (e.g., causes fragmentation, pig mandible model), and pathology (e.g., atrophied in osteoporosis, hypertrophied in osteoarthritis, human proximal femur), and with encroaching mineral particles hardening the usually soft parts. In this way the unobtrusive periosteal SF network may regulate bone status, perhaps even contributing to predictable "hotspots" of trabecular disconnection, particularly at sites of tension prone to fatigue, and with the network deteriorating significantly before bone matrix loss.
KEYWORDS:
collagen type III; collagen type VI; elastin; endosteal membrane; matrix biochemical domains; skeletal aging; tenascincollagen type VI, elastin, tenascin) combined with a multiaxial pattern of insertion suggesting a role more complex than attachment alone would justify. A proportion permeate the cortex to the endosteum (and beyond), fusing into a CIII-rich osteoid layer (<2 μ thick) encompassing all resting surfaces, and with which they apparently integrate into a PERIOSTEAL-SHARPEY FIBER-ENDOSTEUM (PSE) structural continuum. This intraosseous system behaves in favor of bone loss or gain depending upon extraneous stimuli (i.e., like Frost’s hypothetical “mechanostat”). Thus, the birefringent fibers are sensitive to humoral factors (e.g., estrogen causes retraction, rat femur model), physical activity (e.g., running causes expansion, rat model), aging (e.g., causes fragmentation, pig mandible model), and pathology (e.g., atrophied in osteoporosis, hypertrophied in osteoarthritis, human proximal femur), and with encroaching mineral particles hardening the usually soft parts. In this way the unobtrusive periosteal SF network may regulate bone status, perhaps even contributing to predictable “hotspots” of trabecular disconnection, particularly at sites of tension prone to fatigue, and with the network deteriorating significantly before bone matrix loss.
Keywords: collagen type III, collagen type VI, tenascin, elastin, matrix biochemical domains, skeletal aging, endosteal membrane
PERIOSTEUM AND SHARPEY’S FIBERS
PERIOSTEUM
This
strong, encapsulating skeletal membrane containing osteoprogenitor
cells consists of an outer fibrillar layer and an inner cellular layer
that is usually poorly defined unless actively engaged in osteoid
apposition. Despite its relatively low visual impact it defines vital
developmental boundaries. Extending from it are the Sharpey’s fibers
that ensure adhesion to the outer cortex and to tendons and ligaments,
themselves perceived as modified periosteum (Hurle et al., 1989).
While the unstressed periosteum seems biochemically quiescent, short
bursts of loading stimulates the rapid induction of enzyme activity
within discrete periosteal and bone matrix domains (Skerry et al., 1989) apparently by the mediation of signals to selected regions.
SHARPEY’S FIBERS
These delicate optical features (Figures Figures11 and and22)
described as “perforating fibers” by William Sharpey, cross matrix
lamellae and are particularly abundant in the alveolar socket of the
teeth (Sharpey et al., 1867). Also reporting them at this time was H. Muller (Quain’s Elements of Anatomy, 1867) who recognized the elastic nature of the fibers and a tendency to “escape calcification.” Later Weidenreich (1923),
citing Koelliker (1886), confirmed their poorly mineralized status, and
although they were apparently short and superficial he was of the
opinion that they influenced not only the external anatomy but also the
internal bone structure. From another quarter were reports by Tomes (1876) and Black (1887) that embedded Sharpey’s fibers constituted the cemento-alveolar fibers of the periodontal ligament, and in due course Cohn (1972) mapped their passage through the cementum and on across the entire thickness of the alveolar wall (Quigley, 1970). Other related reports followed, such as that by Jones and Boyde (1974)
outlining further their presence in the cranial sutures and muscle
attachments as well as in tooth sockets. However, the subsequent
literature focused almost exclusively on Sharpey’s fibers functioning as
the periodontal ligament and how this special dental structure altered
with age both organically and inorganically, weakening its tooth-holding
capacity. The detrimental changes observed included fibrosis, increased
cellularity, and progressive calcification (Sloan et al., 1993).

Photomicrograph
of a typical representative array of three periosteal Sharpey’s fibers
(black arrows), each about 15 μm thick, and extending from the
periosteum (P), through the bone (B) toward the endosteum outside which
is the marrow ...

Photomicrograph
of two typical representative collagen type III-rich Sharpey’s fibers,
about 10 μm thick, and fluorescing positive within the negative
calcified bone matrix. Human proximal femur. FITC-immunostain for CIII, UV epifluorescence ...
At
the present time, sufficient evidence is now accumulating to suggest
that the relative neglect of those abundant Sharpey’s fibers located
away from the dentition may be unjustified. In redressing the balance in
favor of their structural significance elsewhere in the skeleton, and
complementing the classification of Johnson (1987), Al-Qtaitat (2004), 2007 identified two types of Sharpey’s fibers (see also Al-Qtaitat et al., 2010),
one coarse (8–25 μm thick) and the other fine (<8 μm thick). Their
entry angle into the subperiosteal bone was multiaxial. It included the
almost horizontal (i.e., tangential) fibers especially common with age
and often found among inserting muscle fascicles, functionally
propagating biomechanical exchange across the periosteum. It also
included the perpendicular (i.e., vertical) fibers, frequently crossing
the cortex to the cancellous region and generally of the coarse type in
bundles <40 μm thick, functionally adding complexity to the
muscle-to-bone interface that may influence bone atrophy, augmentation,
and remodeling. In addition were the oblique fibers, these being the
most numerous and predominant in the young skeleton, functionally
mediating exchange between the periosteum and outer cortex and providing
soft tissue anchorage. While some of these insertions apparently ended
abruptly (like rows of short, regular parallel stitches), it was the
proportion that traversed to the medulla, some becoming intertrabecular,
others with dispersed intra-osseous fan-like termini that were of
special interest. Added to this was their unusual profile in transverse
section, which was not the simple circle expected but showed sharply
defined surface indentations and configurations ranging from a
horseshoe-shape to a “hollow” core (Aaron and Skerry, 1994).
Further
examination using an established histochemistry test for elastin
(Verhoeff’s stain) supported the observation of Muller above that
(unlike collagen type I, CI) they have elastic properties that can
absorb strain. Moreover, the elastin staining was not uniform but
suggested the discrete contours of a spiral encircling some of the
individual coarse fibers (Aaron and Skerry, 1994).
The mechanical properties of elastin are unique. Unlike non-extensible
collagen it can be stretched, recoils, branches, and imparts
flexibility. However, it has been rarely documented in bone (Johnson and Low, 1981; Keene et al., 1991),
except, that is, at sites of tendon and ligament insertion, and its
presence will alter the biophysical properties of the Sharpey’s fibers.
IMMUNOHISTOCHEMISTRY OF SHARPEY’S FIBERS
It
required a technological advance to demonstrate the otherwise hidden
scale of Sharpey fiber permeation and to establish their biochemical
composition more extensively (see Aaron and Shore, 2004b
for technical details). Polarized light showed a highly birefringent
nature consistent with collagen, but little else could be deduced by
simple staining (Smith, 1960), with for example picro-sirius red stain, or by the Goldner tetrachrome method (Aaron and Shore, 2004b). The prospect was transformed by the introduction of heavy duty cryomicrotomy (see for example, Aaron and Carter, 1987; Carter et al., 1989),
combined with the increasing availability of a widening range of
specific fluorescent antibodies. Prior to this, the organic matrix
biochemistry was based on tissue homogenates and extracts. The new
method enabled a structural face to be applied. This identified
previously unsuspected matrix sub-divisions, showing a mosaic of
biochemically distinct domains, defined by boundaries and with
differential aptitudes for signal trafficking through, for example,
endochondrally derived versus intramembranous regions. Perhaps foremost
among these potentially transducing macomolecules is collagen type III
(CIII). It is this together with amounts of collagen type VI (CVI),
tenasin, fibronection, and elastin, that are now known to characterize
the Sharpey’s fibers, meaning that structurally they are considerably
more complex than was previously supposed, and especially complex for
structures fulfilling the relatively uncomplicated function of anchorage
traditionally assigned to them.
An advance
in their histochemical differentiation had pre-empted their
immunohistochemistry with descriptions of certain “argyrophilic” matrix
fibers (Nowack et al., 1976; Carter et al., 1991
for references), which in retrospect were found to be coincident in
distribution with CIII immunostaining. As with the more prominent CI, so
CIII is also found in all interstitial connective tissues but in
contrast there was little evidence for its occurrence in bone, with the
exception of the earliest mesenchymal condensations (Pratt, 1959; Page et al., 1986), and its well documented appearance in alveolar bone (Becker et al., 1986). The application of CIII immunostaining (Figure Figure22) has now transformed this state of affairs (Wang et al., 1980), leaving in no doubt its discrete structural affinity for the birefringent Sharpey’s fibers.
Collagen type III
It
is recognized that different collagens, e.g., CI and CIII can be
present in the same fibril to modulate its physical properties. Like CI,
the structure of CIII consists of long (300 nm) uninterrupted triple
helices, chemically distinguished from CI by an increased level of 4-Hyp
and the occurrence of cysteine, facilitating disulphide bond formation.
In contrast to the high tensile strength of CI fibers, those of CIII
are thinner and less orderly (Kielty et al., 1993)
and they are prevalent in tissues with clear elastic properties,
including skin, aorta, lung, and gut. As well as being argyrophilic,
above, these fibers were known histologically as reticulin fibers, and
were especially associated with epithelial basement membrane stability,
where their contribution to organ containment cannot be overestimated.
It was reported by Bailey et al. (1993)
that in normal human bone CIII content averaged 4–5%, with 3% in
osteoporotic bone. Similarly in culture conditions osteoblast-like cells
have been said to secrete about 6% CIII (Aufmokolk et al., 1985; see Luther, 1998
for references). The collagens CI, II, and III are all translated from
mRNA coding for pre-proα chains with similar, but not identical, N- and
C-terminal extensions. The partnership of CIII with CVI is reported to
provide exceptional stability (e.g., Hulmes, 1992; Sherwin et al., 1999)
and this combination in Sharpey’s fibers must have fundamental
implications for their persistence in a tissue with the versatility and
turnover of bone.
Collagen type VI
A structural association between CIII and CVI in bone was reported by Becker et al. (1986), and CVI was said to be reduced in osteoporosis (OP; Bailey et al., 1993)
although the implications were not clear. CVI is microfibrillary,
composed of a short triple helical axis and globular termini, creating
its typical dumbell shape. It has many adhesive RGD sequences and like
CIII has stabilizing disulfide bonds (Hulmes, 1992). It has been suggested that the removal of CVI is a factor that may permit remodeling (Sloan et al., 1993).
From the above evidence it is clear that Sharpey’s fibers are uniquely placed and have the morphological complexity (Figure Figure33)
to mediate musculoskeletal cohesion and exchange. They are the only
continuous anatomical structure to (i) integrate directly with the
muscles, ligaments, and tendons, (ii) traverse the periosteum from which
they arise, and (iii) permeate the extracellular matrix multiaxially
and to varying degrees. Insight into their most basic structural
modulation may be found in tooth movement where orthodontic forces
strengthen the CIII periodontal attachment (Wang et al., 1980)
by increasing the diameter of the Sharpey’s fibers. Again, in calvarial
bone, the Sharpey’s fibers are organized relative to the pull of the
masticatory muscles (Simmons et al., 1993), while in spaceflight there is apparently disorganization of the subperiosteal collagen fibrils (Wronski and Morey, 1983; Vailas et al., 1988).

Diagram showing (A)
a stylized CIII/CVI-rich periosteal Sharpey’s fiber with adherent
beaded chains of tenascin and encircled by a coil of elastin, and (B) tracings of the same coarse fibers (about 15 μm diameter) in cross section showing ...
There
now follows seven reasons why the Sharpey’s fiber network may act as an
extracellular regulatory system in bone. Its candidature has been a
lengthy one. Though not assigned as such, elements of the trabecular
framework proposed below probably commenced in the seventeenth century
at the dawn of microscopy with descriptions by Clopton Havers (Dobson, 1952)
of penetrating “fibrillae,” thereby possibly preceding Sharpey himself.
The precise nature of the musculoskeletal exchange mechanism instigated
remains to be established, for example, a piezoelectric phenomenon (the
piezoelectric modulus of tendon is apparently 30-fold that of bone; Marino and Becker, 1971) or one involving stress-regulated excitatory amino acids analogous to neural pathways (Mason et al., 1997)
may be considered; there is also evidence that the ligaments with which
the Sharpey’s fibers integrate may function as proprioceptors (Johansson et al., 1991).
SHARPEY’S FIBERS IN FETAL BONE DEVELOPMENT (FIBRONECTIN AND TENASCIN FACTORS)
A
system of Sharpey’s fibers continuous with the ectodermal membrane is
present from an early embryonic stage. They appear as dorso-ventral
fibrillar bundles, about 1μm thick, containing also CI, fibronectin, and
tenascin. They occupy an area that becomes an intracortical CIII-rich
domain in the limb bud that is linked to tendon generation (Hurle et al., 1989)
and variations from the norm can have pathological consequences. This
is illustrated by comparing intramembranous bone development in the
normal human femoral anlagen with that of dysplastic lesions (Carter et al., 1991).
Key structural molecules in the genesis of new trabeculae are not only
collagen types III and VI, but also adherent are the glycoproteins
tenascin and fibronectin. Regarded as “biological organizer” molecules
they carry the adhesive RGD sequence, fibronectin apparently influencing
fibroblast migration. However, in relation to Sharpey’s fibers it is
tenascin that seems to have a special role, where it may mediate
attachment of osteoblasts by means of its cell recognition signal (Ruoslahti and Pierschbacher, 1986).
The occasional surface location of alkaline phosphatase on some fibers
may relate to this signal and may indicate the expansion of thinner
fibers with circumferential apposition in response to brief loading (Aaron, 1980b). Immunostaining for tenascin indicates that it adopts a highly characteristic beaded pattern (Figure Figure33) the linear alignment of which is critical for normal development, as follows.
Contiguous
with the periosteum surrounding developing intramembranous bone are
arrays of CIII-rich Sharpey’s fibers which apparently form a scaffold
upon which the new trabeculae are assembled and the bone modeling event
takes place. The framework is recognized by antibodies to CI and
fibronectin, but these affinities disappear as the Sharpey’s fibers
become surrounded by calcified bony tissue. Remaining in association,
however, is tenascin in a remarkable regular beaded arrangement. The
intramembranous bone formation can only apparently continue in an
orderly manner toward maturity on condition that tenascin is
specifically associated with the Sharpey’s fibers at this crucial stage.
In its absence the bony tissue is permanently destined to remain
disorganized and immature, as is the case in fibrous dysplasia (Sloan et al., 1989; Carter et al., 1991).
The
preliminary framework appears to persist to maturity (being absent from
endochondrally derived bone) as periosteal myotendinous insertions of
Sharpey’s fibers. By providing this continuous, elastic (Keene et al., 1991)
intermediary between the developing musculature and the developing bone
matrix the CIII fibers may enable the translation of stresses generated
by contractile tissues into compliant modeling and remodeling of the
contiguous trabecular architecture in the femoral anlagen (Pratt, 1959; Wong and Carter, 1990).
It may be envisaged that an understanding of such interactions between
organizing proteins (like tenascin and fibronectin) and extracellular
structures like CIII fibers which are fundamental to early trabecular
development in the first stages of life may direct novel strategies for
restitution of the atrophied skeleton in later life.
SHARPEY’S FIBERS IN MATURE BONE REPAIR FOLLOWING ABLATION (THE ENDOSTEUM FACTOR)
Just
as damage to the adult periosteum stimulates the polarized extension of
its Sharpey’s fibers to re-establish lost continuity, so also does the
endosteum appear to be similarly stimulated when damaged experimentally,
as in the course of tissue ablation of a cylindrical hole in the ovine
pelvic girdle caused by the removal of an 8 mm diameter trephine bone
biopsy (Aaron and Skerry, 1994).
Picking up the damaged threads, and considerably more numerous where
there are bone fragments (a likely source of local growth factors),
there arises from the excised surfaces marshaled arrays of uncalcified,
discrete coarse (5–25 μm) birefringent fibers, converging centripetally.
It is upon this assembly that the replacement primary trabeculae gain
support, and in regions where the scaffold is absent, so also absent is
trabecular genesis. This endosteally derived fibrous framework remains
unmineralized and therefore apparently protected from osteoclastic
resorption (Aaron, 1980a),
aided by other inhibitory intrinsic factors such as CVI. It apparently
survives, even when the thickening primary bars are significantly opened
up by resorption channels into a typical network of mature secondary
trabeculae. The outcome of this endosteal activity is the guaranteed
presence of a persistent fibrillar assembly that crosses domain
boundaries without interruption, bonding soft to hard tissues and new
bone to old, and which seems central to a self-repair process of
admirable efficacy. Thus, the subperiosteal trabecular generation of
embryonic skeletal development in Section “Sharpey’s Fibers in Fetal
Bone Development (Fibronectin and Tenascin Factors)” above is conserved
and recapitulated subendosteally in the adult in response to insult (and
possibly also sclerotic pathology such as Paget’s disease).
....-
an associated decline in muscle insertions. The apparent demise of the proximal domain in this way was accompanied by a significant reduction in both the length and the number of CIII/CVI fibers.

Diagram
of a mature rat femur showing the gross configuration of the expansive
CIII/CVI-rich proximal domain of Sharpey fiber bone (striped area),
terminating in CII/CVI-rich “anchors” (round dots), (A) in a normal control, (B) expanded ...
Tenaskiini -W voi olla syövän merkitsijäproteiini
BMC Clin Pathol. 2012 Sep 4;12:14. doi: 10.1186/1472-6890-12-14. Tenascin-W is a better cancer biomarker than tenascin-C for most human solid tumors.
Brellier F1, Martina E, Degen M, Heuzé-Vourc'h N, Petit A, Kryza T, Courty Y, Terracciano L, Ruiz C, Chiquet-Ehrismann R.
- Tenaskiinit ovat isoja glykoproteiineja, joita extrasellulaarimatrisista löytyy monessa alkion ja täysikäisen kudoksessa. Tenaskiini-C on hyvin tutkittu biomerkitsijä, jonka esiintymä useimman solidin tuumorin stroomassa on koholla. Tenaskiini-W on vähiten tutkittu tämän perheen jäsenistä ja sitä on runsaasti ilmenevänä paksunsuolen syövän, rintasyövän ja glioomien stroomassa, mutta vastaavista normaaleista kudoksista se ei ole löydettävissä. Tutkijat selvittelevät, .voisiko tenaskiini-W olla laajemminkin solidien tuumorien spesifinen extrasellulaarimatrixproteiini
Tenascins are large glycoproteins found in the extracellular matrix of many embryonic and adult tissues. Tenascin-C is a well-studied biomarker known for its high overexpression in the stroma of most solid cancers. Tenascin-W, the least studied member of the family, is highly expressed in the stroma of colon and breast tumors and in gliomas, but not in the corresponding normal tissues. Other solid tumors have not been analyzed. The present study was undertaken to determine whether tenascin-W could serve as a cancer-specific extracellular matrix protein in a broad range of solid tumors.
- Tutkijat selvittivät immunologisin ja immunohistokemiallisin menetelmin tenaskiini-W:n (TNW) ja tenaskiini-C:n (TNC) ilmenemät haima-, munuais- ja keuhkosyöpäleikkeistä sekä melanoomasta ja vertasivat löytöjä terveisiin kudoksiin.
- Kaikista tutkituista terveistä ihmiskudoksisa vain maksasta ja pernasta oli hjavaittavissa tenaskiini-W pitoisuuksia ja tämä viitaisi siihen, että tenaskiini-W puuttuu useimmista täysi-ikäisen elimistä normaalisti, ei -patologisissa olosuhteissa.
- Sitävastoin tenaskiini W.tä oli havaittavissa useimmissa melanoomissa ja niiden metastaseissa, samoin haima- munuais- ja keuhkokarsinoomassa. Kun verrattiin keuhkotuumosinäytteitä vertaiskontrollien kudoksiin havaittiin joka potilaalla selvä tenaskiini-W:n yliexpressio
- Vaikka tutkittujen näytteiden määrä on liian pieni statistisesti merkittävien johtopäätösten vetämiseen, näyttää kuitenkin olevan trendiä W- tenaskiinin lisääntymään korkeaasteisissa tuumoreissa. usseimmissa tuumorityypeissä tenaskiini-W esiintyi verisuoniston läheisyydessä kuten näytteiden CD31 samanaikaisvärjäys osoittaa
Although the number of samples examined is too small to draw statistically significant conclusions, there seems to be a tendency for increased tenascin-W expression in higher grade tumors. Interestingly, in most tumor types, tenascin-W is also expressed in close proximity to blood vessels, as shown by CD31 co-staining of the samples.
Johtopäätöksiä: Tässä tutkimuksessa laajennetaan tenaskiini-W:n käyttöaluetta solidien tuumorien mahdollisena biomerkitsijänä ja osoitetaan että se on saavutetavissa verenvirtauksen kautta, mikä mahdollistaa terapeuttisia strategioita.
NCP: Tenaskiinit
TENASKIINI.
Tenaskiinit ovat extrasellulaaristen
(ECM) glykoproteiinien perhe. Ne ovat multifunktionaalisia ja
suorittavat sidekudossignalointia .Niillä on osuutta myös synapsin plastisuudessa.Ne ovat multifunktioproteiineja.
Wikipedialähde antaa tenaskiinin rakenteesta kuvan C- terminaali, N-terminaali
Fibronektiini tyyppi III- domeeni näkyy tenaskiinin rakenteessa. C-terminaali ( punavärillä ja N- terminaali sinivärillä.
TENASKIINI on extrasellulaarinen matrixglykoproteiini. Sitä on runsaasti kehittyvän selkärankaisalkion extrasellulaarisessa matrixissa ja sitä ilmenee uudestaan parantuvien haavojen ympärillä ja joidenkin tuumorien stroomassa.
TENASKIINITYYPIT, GEENIT
Tenaskiinia on neljä tyyppiä: C, R, X j ja W.- Tenaskiini C on geeniperheen perusjäsen Alkiossa sitä valmistuu neuraalipoimun migroituvista soluista. Sitä on myös runsaasti kehittyvissä jänteissä, luussa ja rustossa.. Sen geeni on TNC ja sijaitsee kromosomissa 9q33. Koodautunut tenaskiini-C- proteiini on 2200 aminohappoa.
Tenascin-C
)is the founding member of the gene family. In the embryo it is made
by migrating cells like the neural
crest; it is also abundant in developing tendons,
bone and cartilage.
- Tenaskiinia- R on löydettävissä kehittyvässä ja täysikäisessä hermokudoksessa. KTS: synaptisesta plastisuudesta suomalainen artikkeli, josa tenaskiinit mainitaan: http://www.tietysti.fi/Tiedostot/Tapahtumat/Taira,%20Lauri,%20Rauvala%20Duodecim%202003.pdf
Sen geeni on TNR ja sijaitsee kromosomissa 1q24. Geenin koodamaa tenaskiini-R on 1357 aminohappoa. Edellisen kaltainen on tenaskiini-N, geeni TNN löytyy läheltä kromosomiasemasta 1q23-q24. Tämä on "novel", uudempi löytö.
Tenascin-R
is found in the developing and adult nervous system.
- Tenaskiini-X on löydettävissä ensisijassa höllässä sidekudoksessa. Ehlers-Danlosin oireyhtymää voi seurata tenaskiini-X geenin mutaatioista. Tästä löydän kaksi geeni mainintaa. TNXB geeni, sijainti kromosomissa 6p21.3 ja se koodaa proteiinia, jossa on 4241 aminohappoa. Pseudogeeni , "TenaxinX-like" on TNXA ja sen asema on 6p21.3.
Tenascin-X
is found primarily in loose connective tissue; mutations in the human
tenascin-X gene can lead to a form of Ehlers-Danlos
syndrome. [2]
- Tenaskiini-W
on löydettävissä munuaisesta ja kehittyvästä luusta.
Tätä geeniä en löytänyt ihmiseltä UniGene kirjastosta. Hain sitten suoralla haulla PubMed hakulaitteesta ja siinä maintiaan tenaskiini W proteiinin ilmenemisestä tuumoreissa ja sen käytöstä tuumorin karsinoman merkitsijänä. Tästä otan sitaatin ja suomennan seuraavassa artikkelissa.
TENASKIININ PERUSRAKENNE
Tenaskiinin perusrakenteessa on 14 EGF:n kaltaista toistoa N-terminaalia kohden ja 8 tai usempi fibronektiini-III domeenia, jotka vaihtelevat eri lajeissa ja varianteissa.
The basic structure is 14 EGF-like repeats towards the N-terminal end, and 8 or more fibronectin-III domains which vary upon species and variant.
Tenaskiini-C
on tarkimmin tutkittu tämän perheen jäsen. Sen anti-adhesiivinen
ominaisuus aiheuttaa, että soluviljelyn solut pyöristyvät, kun
sitä lisätään kudosviljelyväliaineesseen. Eräs mahdollinen
mekanismi, joka tämän selittäisi, lie sen kyky sitoutua
extrasellulaarisen matrixin glykoproteiinin fibronektiiniin ja
blokeerata fibronektiinin ja sepsifisten syndekaanien
väliset vuorovaikutukset. Jos
tenaskiini-.C:tä ilmenee jonkun tuumorin stroomassa, tämä ilmiö
liittyy huonoon prognoosiin.
Tenascin-C is the most intensly studied
member of the family. It has anti-adhesive properties, causing cells
in tissue culture to become rounded after it is added to the medium.
One mechanism to explain this may come from its ability to bind to
the extracellular matrix glycoprotein fibronectin
and block fibronectin's interactions with specific syndecans.
The expression of tenascin-C in the stroma of certain tumors is
associated with a poor prognosis.
Viitteet:
- PDB 1TEN; Leahy DJ, Hendrickson WA, Aukhil I, Erickson HP (November 1992). "Structure of a fibronectin type III domain from tenascin phased by MAD analysis of the selenomethionyl protein". Science 258 (5084): 987–91. doi:10.1126/science.1279805. PMID 1279805.
- Bristow J, Carey W, Egging D, Schalkwijk J (2005). "Tenascin-X, collagen, elastin, and the Ehlers-Danlos syndrome". Am J Med Genet C Semin Med Genet139 (1): 24–30. doi:10.1002/ajmg.c.30071. PMID 16278880.
- Chiquet-Ehrismann R, Chiquet M (2003). "Tenascins: regulation and putative functions during pathological stress". J Pathol 200 (4): 488–99. doi:10.1002/path.1415. PMID 12845616.
- Chiquet-Ehrismann R, Tucker R (2004). "Connective tissues: signalling by tenascins". Int J Biochem Cell Biol 36 (6): 1085–9. doi:10.1016/j.biocel.2004.01.007. PMID 15094123.
- Hsia H, Schwarzbauer J (2005). "Meet the tenascins: multifunctional and mysterious". J Biol Chem 280 (29): 26641–4. doi:10.1074/jbc.R500005200. PMID 15932878.
- Jones F, Jones P (2000). "The tenascin family of ECM glycoproteins: structure, function, and regulation during embryonic development and tissue remodeling". Dev Dyn218 (2): 235–59. doi:10.1002/(SICI)1097-0177(200006)218:2<235::AID-DVDY2>3.0.CO;2-G. PMID 10842355.
Sklerostiini (SOST) on osteosyytin erittämä gp. ( BMP- antagonisti).
Sclerostin (SOST)

Sclerostin
is a secreted glycoprotein with a C-terminal cysteine knot-like (CTCK)
domain and sequence similarity to the DAN (differential
screening-selected gene aberrative in neuroblastoma) family of bone
morphogenetic protein (BMP) antagonists.
Loss-of-function mutations in
this gene are associated with an autosomal-recessive disorder,
sclerosteosis, which causes progressive bone overgrowth.
A deletion
downstream of this gene, which causes reduced sclerostin expression, is
associated with a milder form of the disorder called van Buchem
disease.
Sclerostin is produced by the osteocyte. These cells originate
from osteoblasts, the cells that form the bone matrix.
Sclerostin has an
inhibitory effect on the life time of the osteoblast. Osteoblasts are
self limiting by a negative feedback system.
Suomennos puuttuu.
Osteosyytin funktio ja sklerostiinin merkitys. Luumassan negatiivinen säätelijä
SCLEROSTIN( SOST gene product Kr. 17q11.2 , suomennosta artikkelista
http://www.ncbi.nlm.nih.gov/UniGene/clust.cgi?UGID=193702&TAXID=9606&SEARCH=Sclerostin
J Bone Joint Surg Am. 2014 Oct 1;96(19):1659-1668. A Review of Osteocyte Function and the Emerging Importance of Sclerostin.
http://www.ncbi.nlm.nih.gov/UniGene/clust.cgi?UGID=193702&TAXID=9606&SEARCH=Sclerostin
J Bone Joint Surg Am. 2014 Oct 1;96(19):1659-1668. A Review of Osteocyte Function and the Emerging Importance of Sclerostin.
Tiivistelmä
Osteoblastista peräisin olevat osteosyytit sijaitsevat luussa ja kommunikoivat laajamittaisesti luun muitten solupopulaatioitten kannsa säädellen luun aineenvaihduntaa. Kypsä osteosyytti ilmentää sklerostiini-nimistä proteiinia ja se on luumassan negatiivinen säätelijä.
Abstract
Osteoblastista peräisin olevat osteosyytit sijaitsevat luussa ja kommunikoivat laajamittaisesti luun muitten solupopulaatioitten kannsa säädellen luun aineenvaihduntaa. Kypsä osteosyytti ilmentää sklerostiini-nimistä proteiinia ja se on luumassan negatiivinen säätelijä.
Abstract
➤
Osteocytes, derived from osteoblasts, reside within bone and
communicate extensively with other bone cell populations to regulate
bone metabolism. The mature osteocyte expresses the protein sclerostin, a negative regulator of bone mass.
Normaalissa fysiologisessa tilassa sklerostiini-proteiini vaikuttaa luupinnan osteoblasteihin ja ilmentää eri tapaisia vasteita mekaaniseen rasitukseen, tulehdusmolekyyleihin kuten prostaglandiinin PGE2 ja hormoneihin kuten PTH ja estrogeeni.
➤ In normal physiologic states, the protein sclerostin acts on osteoblasts at the surface of bone and is differentially expressed in response to mechanical loading, inflammatory molecules such as prostaglandin E2, and hormones such as parathyroid hormone and estrogen.
Mitä patologiaan tulee sklerostiinin säätelyhäiriötä on havaittu osteoporoosiin liittyvissä luunmurtumissa, implantaatin osseointegraation epäonnistumisessa, metastaattisissa luutaudeissa ja joissain luumassan geneettisissä taudeissa.
➤ Pathologically, sclerostin dysregulation has been observed in osteoporosis-related fractures, failure of implant osseous integration, metastatic bone disease, and select genetic diseases of bone mass.
Parhaillaan on kliinisen kokeen III vaiheessa eräs sklerostiiniin kohdistuva vasta-aine, joka vähentää sklerostiinin endogeenisiä pitoisuuksia ja samalla lisää luun mineraalitiheyttä.
➤ An antibody that targets sclerostin, decreasing endogenous levels of sclerostin while increasing bone mineral density, is currently in phase-III clinical trials.
Osteosyytti on saanut asemaa monipuolisena, välttämättömänä luusoluna. Sen sijainti luun sisällä, sen laaja dendriittiverkosto ja läheinen kommunikaatio systeemiseen verenkiertoon ja muihin luun soluihin tarjoaa useita mahdollisuuksia hoitaa lukuisia ortopedisiä tiloja.
➤ The osteocyte has emerged as a versatile, indispensable bone cell. Its location within bone, extensive dendritic network, and close communication with systemic circulation and other bone cells produce many opportunities to treat a variety of orthopaedic conditions.
Copyright © 2014 by The Journal of Bone and Joint Surgery, Incorporated.
Normaalissa fysiologisessa tilassa sklerostiini-proteiini vaikuttaa luupinnan osteoblasteihin ja ilmentää eri tapaisia vasteita mekaaniseen rasitukseen, tulehdusmolekyyleihin kuten prostaglandiinin PGE2 ja hormoneihin kuten PTH ja estrogeeni.
➤ In normal physiologic states, the protein sclerostin acts on osteoblasts at the surface of bone and is differentially expressed in response to mechanical loading, inflammatory molecules such as prostaglandin E2, and hormones such as parathyroid hormone and estrogen.
Mitä patologiaan tulee sklerostiinin säätelyhäiriötä on havaittu osteoporoosiin liittyvissä luunmurtumissa, implantaatin osseointegraation epäonnistumisessa, metastaattisissa luutaudeissa ja joissain luumassan geneettisissä taudeissa.
➤ Pathologically, sclerostin dysregulation has been observed in osteoporosis-related fractures, failure of implant osseous integration, metastatic bone disease, and select genetic diseases of bone mass.
Parhaillaan on kliinisen kokeen III vaiheessa eräs sklerostiiniin kohdistuva vasta-aine, joka vähentää sklerostiinin endogeenisiä pitoisuuksia ja samalla lisää luun mineraalitiheyttä.
➤ An antibody that targets sclerostin, decreasing endogenous levels of sclerostin while increasing bone mineral density, is currently in phase-III clinical trials.
Osteosyytti on saanut asemaa monipuolisena, välttämättömänä luusoluna. Sen sijainti luun sisällä, sen laaja dendriittiverkosto ja läheinen kommunikaatio systeemiseen verenkiertoon ja muihin luun soluihin tarjoaa useita mahdollisuuksia hoitaa lukuisia ortopedisiä tiloja.
➤ The osteocyte has emerged as a versatile, indispensable bone cell. Its location within bone, extensive dendritic network, and close communication with systemic circulation and other bone cells produce many opportunities to treat a variety of orthopaedic conditions.
Copyright © 2014 by The Journal of Bone and Joint Surgery, Incorporated.
Osteosyytti, luusolu
Luussa on kolmen tyypin soluja:
OSTEOSYYTIT ovat luun soluista pitkäikäisimmät ja niiden keskimääräinen puoliintumisaika ihmisluussa on 25 vuotta, vaikka todennäköisesti vähemmän koska vakioinen luun vaihtuvuus on vuosittain 4 - 10%.
Luun muodostuksen aikana joitain osteoblasteja joutuu loukkuun vastamuodostuneen osteoidin matrixin sekaan ja mineralisaation seuratessa kintereillä, ne jäävät sinne mineralisoituvaan matrixiin.
Osteosyyttisolut joiden koko ihmisluussa on 10- 20 um, sijaitsevat lacunoissa ja niistä lähtee dendriittiulokkeita pieniin kanaviin, tunneleihin, joiden kautta ne saavat yhteyksiä toisiin osteosyytteihin luumatrixin sisällä tai luun pinnalla. Tällaisen nestekanavaisen yhdistävän verkoston välityksellä osteosyyteillä on kykyä havaita mekaanista painetta ja rasitusta. Tämä mekanosensorinen kyky voi indusoida luun korjaantumista mikrovaurioista, liikaluunkasvusta tai luun vähentymästä.
. Lisäksi osteosyytit voivat havaita nestetunneleidensa avulla vaihteluja estrogeenin ja glukokortikoidien pitoisuuksissa.
Osteosyytit kykenevät vastaamaan eri tyyppisiin stimuluksiin moduloimalla useitten molekyylien eritystä ja ilmenemää kuten insuliinin kaltaista kasvutekijää, osteokalsiinia(OC) ja sklerostiinia. Osteosyytit voivat säätää myös luuston homeostaasia.
Osteosyytin apoptoosi näyttää olevan välttämätön aloittaja luun remodelaatioprosessille vasteessa väsymysvaurioon. On havaittu myös, että pro-apoptoottisten molekyylien pitoisuudet ovat koholla sellaisissa osteosyyteissä, jotka sijaitsevat lähellä mikromurtumia ( microcracks).
LÄHDE:
Cardemil C. Osteocytes. In: Effects of antiresorptive agents on inflammation and bone regeneration in different osseous sites.p. 3. 2014.
- osteoblasteja ( 4-6%),
- osteoklasteja
- osteosyyttejä ( yli 95% kaikista luun soluista).
OSTEOSYYTIT ovat luun soluista pitkäikäisimmät ja niiden keskimääräinen puoliintumisaika ihmisluussa on 25 vuotta, vaikka todennäköisesti vähemmän koska vakioinen luun vaihtuvuus on vuosittain 4 - 10%.
Luun muodostuksen aikana joitain osteoblasteja joutuu loukkuun vastamuodostuneen osteoidin matrixin sekaan ja mineralisaation seuratessa kintereillä, ne jäävät sinne mineralisoituvaan matrixiin.
Osteosyyttisolut joiden koko ihmisluussa on 10- 20 um, sijaitsevat lacunoissa ja niistä lähtee dendriittiulokkeita pieniin kanaviin, tunneleihin, joiden kautta ne saavat yhteyksiä toisiin osteosyytteihin luumatrixin sisällä tai luun pinnalla. Tällaisen nestekanavaisen yhdistävän verkoston välityksellä osteosyyteillä on kykyä havaita mekaanista painetta ja rasitusta. Tämä mekanosensorinen kyky voi indusoida luun korjaantumista mikrovaurioista, liikaluunkasvusta tai luun vähentymästä.
. Lisäksi osteosyytit voivat havaita nestetunneleidensa avulla vaihteluja estrogeenin ja glukokortikoidien pitoisuuksissa.
Osteosyytit kykenevät vastaamaan eri tyyppisiin stimuluksiin moduloimalla useitten molekyylien eritystä ja ilmenemää kuten insuliinin kaltaista kasvutekijää, osteokalsiinia(OC) ja sklerostiinia. Osteosyytit voivat säätää myös luuston homeostaasia.
Osteosyytin apoptoosi näyttää olevan välttämätön aloittaja luun remodelaatioprosessille vasteessa väsymysvaurioon. On havaittu myös, että pro-apoptoottisten molekyylien pitoisuudet ovat koholla sellaisissa osteosyyteissä, jotka sijaitsevat lähellä mikromurtumia ( microcracks).
LÄHDE:
Cardemil C. Osteocytes. In: Effects of antiresorptive agents on inflammation and bone regeneration in different osseous sites.p. 3. 2014.
måndag 20 oktober 2014
Kortikaalinen luu eli kuoriluu on viskoelastinen ja anisotrooppinen materiaali
Viskoelastisuus tarkoittaa sitä, että
kuormitusnopeus vaikuttaa materiaalin lujuuteen.
Anisotrooppisuus puolestaan sitä, että lujuuteen vaikuttaa kuormituksen suunta
Anisotrooppisuus puolestaan sitä, että lujuuteen vaikuttaa kuormituksen suunta
Luun kuormituksen perustyypit
- Tensio eli venytys
- Kompressio eli puristus
- Shear eli leikkaava voima
- Bending eli taivutus
- Torsio eli kiertokuormitus
- Impakti eli isku
Luukudos ja immuunijärjestelmä (C. Cardemil 2014).
LÄHDE: Väitöskirja Carina Cardemil: Effects of antiresorptive agents on inflammation and bone regeneration in different osseus sites- experimental and clinical studies. University of Gothenburg. ISBN 978-91-628-9108-4.
- Kappale 1.1.4. suomennosta: Bone metabolism . Bone and the immune system sivut 6-7 .
Luun aineenvaihdunta.
Luu muovautuu jatkuvasti ja silloin salliutuu luun kasvaminen, luun paraneminen ja kalsiumin sekä fosfaatin homeostaasin ylläpitäminen. "The Bone remodelling"- tätä luun uudelleen muovatumisprosessia ylläpitävät elävät solut osteoklastit ja osteoblastit. Näiden kahden solutyypin välistä funktionaalista kytkentää säätelevät paikalliset ja systeemiset tekijät- ja epätasapaino luun homeostaasissa voi johtaa patologisiin tiloihin, joita ovat osteopenia, osteoporosis, osteopetrosis- riippuen siitä minkä solutyypin aktiivisuus suosiutuu.
Luu ja immuunijärjestelmä ( BONE and The IMMUNE SYSTEM)
Osteoimmunologia- termiä alkoivat käyttää vuonna 2000 Arron ja Choi kuvatessaan tieteellisen tutkimuksen sitä kentää, joka tutkii luun ja immuunijärjestelmän välisiä vuorovaikutuksia.
Normaalin luun kehityksen aikana ja tulehdustiloissa suorittavat hematopoieettiset ja immuunisolut luun säätelyä tuottamalla paikallisia tai veressä kiertäviä sytokiinejä.
RANKL on reseptoriaktivaattori NF-kB- ligandille.
( Receptor Activator of Nuclear Factor kB Ligand).
RANKL kuuluu TNF- perheeseen ( Tumour Necrosis Factor) ja sillä on kriittinen osa osteoklastiprogeniittorisolun erilaistumisessa täysin aktiiviksi monitumaiseksi osteoklasti-soluksi.
M-CSF, Makrofagien kolonioita stimuloiva tekijä ( Macrophage Colony Stimulating Factor) vaikuttaa myös osaltaan hematopoieettisiin kantasoluihin, jotka sitten alkavat erilaistua makrofageiksi ja osteoklasteiksi (luunsyöjäsoluiksi).
RANKL ilmenee osteoblasteissa ja luuytimen stroomasoluissa (BMSC, Bone Marrow Stromal Cells) sekä myös T-imusoluissa ja B-imusoluissa. RANK on reseptori tälle Ligandille, RANKL.
RANK sijaitsee aktivoituneen osteoklastin pinnalla. Kun RANKL sitoutuu osteoklastin pinnalla olevaan RANK-reseptoriin, edistyy osteoklastin erilaistuminen, proliferoituminen, aktivaatio ja elossapysyminen- mistä loogisesti seuraa tehostunut luun resorboituminen.
Osteoprotegeriini (OPG) on luonnollinen RANKL antagonisti, vastavaikuttaja. Se pystyy estämään tehokkaasti osteoklastogeneesiä ja luun resorboitumista, koska se toimii houkuttimena RANKL- molekyylille ( decoy reseptorina) ja täten blokeeraa RANKL/RANK- vuorovaikutuksen.
RUNX2 on transkriptiotekijä ( Runt-Related Trnacription Factor 2) , joka on välttämätön osteoblastien erilaistumiselle, mutta on voitu myös osoittaa että RUNX2 edistää myöskin osteoklastien erilaistumista saamalla aikaan enemmän RANKL- proteiiniä ja osteoprotegeriinin (OPG) estymistä.
Luun tulehduksellisissa tiloisssa indusoituu melkoinen joukko sytokiinejä, jotka säätelevät luusoluja:
TNF- alfa ( Tumor Necrosis Factor- alfa) niiden joukossa stimuloi osteoklastien muodostumista ja luun resorptiota kehossa.
IL-1, interleukiini-1, on vahva luuresorption stimulaattori ja se vaikuttaa osteoklasteihin lisääntyneen RANKL-tuotannon ja - aktiivisuuden välityksellä.
IL-6, interleukiini-6 tuottuu osteoblasteista ja luuytimen kantasoluista ja se säätelee kypsien osteoklastien kehitystä ja stimuloi myös RANKL ja OPG tuotantoja.
T-solut ja makrofagit osallistuvat myös osteoimmunologiaan tuottamalla klooneja stimuloivia tekijöitä ( CSF, Colony Stimulating Factors) , kemokiinejä ( Chemokines) ja runsaasti interleukiinejä (IL)
Luusolun kuolema
Kun luusolu kuolee, se käy läpi ohjelmoidun solukuoleman ( apoptosis, programmed cell death) ja siinä soluorganellit hajoittuvat organisoidusti . Tämä prosessi on yleistä useissa regeneroituvissa kudoksissa ja samat kasvutekijät (GF) ja sytokiinit, jotka stimuloivat osteoklastin ja osteoblastin kehitystä, voivat myös vaikuttaa niiden apoptoosin.
Osteoprotegeriini (OPG), joka on anti-osteoclastogeeninen ominaisuudeltaan, toimii myös sytotoksisen TRAIL-proteiinin reseptorina ja kun OPG sitoutuu TRAIL-proteiiniin, se estää TRAIL- välitteisen apoptoosin imusoluissa ja säätelee myös antigeenin (ag) esittämistä ja T-solun aktivoitumista.
TRALL ( TNF-related apoptosis-inducing ligand) on sytotoksinen ligandi
Apoptoosin aktivoi kaksi signaalitietä:
(1) Sisäsyntyinen tie, intrinsic pathway, aktivoituu tuumorisupressorigeenin p53 vaikutuksesta vasteena DNA-vaurioon. tai vakavaan solustressiin ( Esim. säteilyt, vapaat radikaalit).
(2) Ulkosyntyinen tie ( extrinsic pathway) aktivoituu proapoptoottisilla ligandeilla, jotka sitoutuvat reseptoreihin solukalvolla.
Molemmissa apoptoosin aktivaatioteissä aktivoituu kaspaaseja ( caspases), jotka ovat solunsisäisiä valkuaisaineita hajoittavia proteaaseja, mikä johtaa solun apoptoosiin.
Näiden kahden apoptoottisen tien kesken lienee myös vuorovaikutusta.
LÄHDE: Cardemil C. Bone and the immunesystem.
In: Effects of antiresorptive agents to inflammation and bone regeneration in different osseous sites- experimental and clinical studies. Pages 6-7. 2014
Päivitys 20.1. 2017
(Alla oleva kuva internetistä esittää glukokortikoidin ylimäärän vaikutuksen luusolujen apoptoosiin).

Etiketter:
interleukiini,
kaspaasi,
kemokiini,
M-CSF,
NFkB,
Osteoimmunologia,
p53,
RANKL/RANK,
sytokiini,
TNF,
TRAIL
NCP: Osteopontiini (OPN). ( SIBLING perhe) Tärkeä luun homeosaasille. , metallin kuljettajaroolia, (Early T-lyphocyte activation ETA-1)
- LÄHDE1. . Crit Rev Oral Biol Med. 2000;11(3):279-303. Osteopontin. Sodek J1, Ganss B, McKee MD.
- Osteopontiini (OPN) on hyvin runsaasti fosforyloitunut sialoproteiini, joka on luun ja hampaitten mineralisoituneitten ECM- matrixien hallitseva komponetti . Sitä luonnehtii poly-aspartaattisekvenssit (dd, ddd) ja Seriini/Treoniini (s/t) -fosforylaatiokohdat, jotka välittävät hydroksiapatiitin (HA) sitoutumista . Niissä on lisäksi hyvin konservoitunut RGD- motiivi, joka välittää soluliittymiä ja -signalointeja. Myös runsaasti glutamiinihappoa( e)
-
ORIGIN 1 mriavicfcl lgitcaipvk qadsgsseek qlynkypdav atwlnpdpsq kqnllapqtl 61 psksneshdh mddmddeddd dhvdsqdsid sndsddvddt ddshqsdesh hsdesdelvt 121 dfptdlpate vftpvvptvd tydgrgdsvv yglrskskkf rrpdiqypda tdeditshme 181 seelngayka ipvaqdlnap sdwdsrgkds yetsqlddqs aethshkqsr lykrkandes 241 nehsdvidsq elskvsrefh shefhshedm lvvdpkskee dkhlkfrish eldsassevn
Osteopontin
(OPN) is a highly phosphorylated sialoprotein that is a prominent
component of the mineralized extracellular matrices of bones and teeth. OPN is characterized by the presence of a polyaspartic acid sequence and
sites of Ser/Thr phosphorylation that mediate hydroxyapatite binding,
and a highly conserved RGD motif that mediates cell
attachment/signaling.
Osteopontiini(OPN) kyky stimuloida soluaktiivisuutta multippelien reseptoreitten kautta, joita on linkkiytyneenä useisiin interaktiivisiin signalointiteihin , selittänee paljon osteopontiinin funktionaalisesta monipulisudesta. Tässä tutkimuksessa tutkijaryhmä keskustelee osteopontiinin rakenteellisista piirteistä, jotka korreloivat sen funktioon luun ja hampaiden muodostumisessa, uudelleen muovautumsiessa ja ylläpidossa.
The ability of OPN to stimulate cell activity through multiple receptors linked to several interactive signaling pathways can account for much of the functional diversity. In this review, we discuss the structural features of OPN that relate to its function in the formation, remodeling, and maintenance of bones and teeth.
- Osteopontiinin (OPN) ilmeneminen lukuisissa eri kudoksissa viittaisi siihen, että sillä on monenlaisia funktioita, joihin osallistuu sen yksi tai usempi konservoitunut motiivi. Kun on tutkittu OPN- poistogeenisiä hiiriä ei ole kuitenkaan havaittu mitään määriteltävissä olevaa roolia osteopontiinille missään kudoksessa, mutta kuitenkin tuoreista tutkimuksista saa uutta ja mielenkiintoista oivallusta tämän arvoituksellisen proteiinin monipuolisuudesta erilaisissa biologisissa tapahtumissa, kuten mm. kehitysprosesseissa, haavan paranemisessa, immuunivasteessa, tumorigeneesissä, luun resorptiossa ja kalkkiutumisessa.
Osteopontiini(OPN) kyky stimuloida soluaktiivisuutta multippelien reseptoreitten kautta, joita on linkkiytyneenä useisiin interaktiivisiin signalointiteihin , selittänee paljon osteopontiinin funktionaalisesta monipulisudesta. Tässä tutkimuksessa tutkijaryhmä keskustelee osteopontiinin rakenteellisista piirteistä, jotka korreloivat sen funktioon luun ja hampaiden muodostumisessa, uudelleen muovautumsiessa ja ylläpidossa.
The ability of OPN to stimulate cell activity through multiple receptors linked to several interactive signaling pathways can account for much of the functional diversity. In this review, we discuss the structural features of OPN that relate to its function in the formation, remodeling, and maintenance of bones and teeth.
- LÄHDE2. Metallomics. 2014 Jan;6(1):166-76. doi: 10.1039/c3mt00269a.
- Characterization of UO2(2+) binding to osteopontin, a highly phosphorylated protein: insights into potential mechanisms of uranyl accumulation in bones. Qi L1, Basset C, Averseng O, Quéméneur E, Hagège A, Vidaud C.
- Luonnehditaan UO2:jonin sitoutuminen osteopontiiniin, joka on runsaasti fosforyloitunut proteiini: Saadaan oivallusta mekanismista, jolla uranyyli voi kertyä luustoon.
Bones
are one of the few organs in which uranyl (UO2(2+)) accumulates. This
large dioxo-cation displays affinity for carboxylates, phenolates and
phosphorylated functional groups in proteins. The noncollagenous protein (NCP)
osteopontin (OPN) plays an important role in bone homeostasis. It is
mainly found in the extracellular matrix of mineralized tissues but also
in body fluids such as milk, blood and urine. Furthermore, OPN is an
intrinsically disordered protein, which, like other proteins of the
SIBLING family, contains a polyaspartic acid sequence and numerous
patterns of alternating acidic and phosphorylated residues. All these
properties led to the hypothesis that this protein could be prone to
UO2(2+) binding.
In this work, a simple purification procedure enabling highly purified bovine (bOPN) and human OPN (hOPN) to be obtained was developed. Various biophysical approaches were set up to study the impact of phosphorylations on the affinity of OPN for UO2(2+) as well as the formation of stable complexes originating from structural changes induced by the binding of this metal cation. The results obtained suggest a new mechanism of the interaction of UO2(2+) with bone metabolism and a new role for OPN as a metal transporter.
OSTEOPONTIIN: Geeni SPP1, BNSP, BSP1, ETA-1, OPN. Kr. 4qww.1
Wikipediateksti
http://en.wikipedia.org/wiki/Osteopontin
In this work, a simple purification procedure enabling highly purified bovine (bOPN) and human OPN (hOPN) to be obtained was developed. Various biophysical approaches were set up to study the impact of phosphorylations on the affinity of OPN for UO2(2+) as well as the formation of stable complexes originating from structural changes induced by the binding of this metal cation. The results obtained suggest a new mechanism of the interaction of UO2(2+) with bone metabolism and a new role for OPN as a metal transporter.
OSTEOPONTIIN: Geeni SPP1, BNSP, BSP1, ETA-1, OPN. Kr. 4qww.1
Wikipediateksti
http://en.wikipedia.org/wiki/Osteopontin
Osteoprotegeriini ja Wnt- signalointi
Nat Med. 2014 Oct 12. doi: 10.1038/nm.3654. [Epub ahead of print]
Osteoblast-derived WNT16 represses osteoclastogenesis and prevents cortical bone fragility fractures.
TIIVISTELMÄ
(Wnt = on Wingless-related integration site)
Abstract
(Wnt = on Wingless-related integration site)
- WNT16 locus on ihmisellä tärkeä merkitsijä kortikaalisen (kuori-) luun paksuudesta ja muitten kuin nikamien luitten murtumariskistä. Osteoporoosin aiheuttamien luunmurtumien ( tässä ei lasketa nikamaluhistumia mukaan) tuottamat invaliditeetit, kuolleisuus ja ekonomiset kustannukset ovat suunnattomia.
- Tutkijaryhmä osoittaa tässä työssään, että Wnt-vajeisilla hiirillä kehittyi spontaanisti luunmurtumia siitä syystä, että luitten kortikaalinen (luun kuoriosan) paksuus oli vähäinen ja kuoriosa oli kovin hauraanhuokoista.. Sen sijaan trabekulaarinen luutilavuus ei näillä hiirillä vaikuttunut.
- Mekanistisilla tutkimuksilla saatiin selville, että WNT16 on osteoblasteista peräisin ja estää ihmisellä ja hiirellä osteoklastogeneesiä eli luun syöjäsolujen muodostumista. WNT16 saa tällaista estämistä aikaan vaikuttamalla suoraan osteoklastien esisoluihin ( progeniittorisoluihin) ja epäsuoraan lisäämällä osteoprotegeriinin (OPG) ilmenemää osteoblasteissa.
- WNT16 käyttää non-kanonista signaloimistietä osteoklastiprogeniittorivaikutukseen, mutta aktivoidessaan osteoblastia se käyttää sekä kanonista että non-kanonista signaalititietä.
- Wnt16- inaktivaatiotutkimuksilla saatiin selville, että osteoblastilinjan solut ovat pääasiallinen WNT16 alkulähde. Jos nyt kohdennetusti tehdään WNT16 deleetio osteoblastiin, lisääntyy murtuma-alttius.
- Osteoblastiperäinen WNT16 on täten aiemmin raportoimaton avainsäätelijä osteoklastogeneesissä ja luunmurtuma-alttiudessa. Näistä löydöistä aukenee uusia väyliä murtumien ( muiden kuin nikamamurtumien) spesifiseen ehkäisyyn, mihin on suurta lääketieteellistä tarvetta.
Abstract
The
WNT16 locus is a major determinant of cortical bone thickness and
nonvertebral fracture risk in humans. The disability, mortality and
costs caused by osteoporosis-induced nonvertebral fractures are
enormous. We demonstrate here that Wnt16-deficient mice develop
spontaneous fractures as a result of low cortical thickness and high
cortical porosity. In contrast, trabecular bone volume is not altered in
these mice. Mechanistic studies revealed that WNT16 is osteoblast
derived and inhibits human and mouse osteoclastogenesis both directly by
acting on osteoclast progenitors and indirectly by increasing
expression of osteoprotegerin
(Opg) in osteoblasts. The signaling pathway activated by WNT16 in
osteoclast progenitors is noncanonical, whereas the pathway activated in
osteoblasts is both canonical and noncanonical. Conditional Wnt16
inactivation revealed that osteoblast-lineage cells are the principal
source of WNT16, and its targeted deletion in osteoblasts increases
fracture susceptibility. Thus, osteoblast-derived WNT16 is a previously
unreported key regulator of osteoclastogenesis and fracture
susceptibility. These findings open new avenues for the specific
prevention or treatment of nonvertebral fractures, a substantial unmet
medical need.
- PMID:
- 25306233
- [PubMed - as supplied by publisher]
http://www.google.se/url?sa=i&rct=j&q=&esrc=s&source=images&cd=&cad=rja&uact=8&ved=0CAcQjRw&url=http%3A%2F%2Fwww.nature.com%2Fnrrheum%2Fjournal%2Fv9%2Fn6%2Ffull%2Fnrrheum.2013.25.html&ei=neNEVP6tNau1ygPN3ILgDw&bvm=bv.77648437,d.bGQ&psig=AFQjCNF8ZX_Iop2OL9fZLOzvAn8SbgSlgw&ust=1413887221341295
Prenumerera på:
Kommentarer (Atom)

